题目内容
17. 如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数.回答下列问题:
如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═ZnO22-+2H2O.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是8.0~12.0.
分析 (1)由图可知,NaOH过量时,溶液中存在ZnO22-;
(2)由a点可知c(Zn2+)、c(OH-),Ksp=c(Zn2+)×c2(OH-);
(3)某废液中含Zn2+,为提取Zn2+,先转化为沉淀,结合图判断pH范围.
解答 解:(1)由图可知,NaOH过量时,溶液中存在ZnO22-,则往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═ZnO22-+2H2O,
故答案为:Zn2++4OH-═ZnO22-+2H2O;
(2)由a点可知c(Zn2+)=10-3mol/L、c(OH-)=10-7mol/L,则Zn(OH)2的溶度积Ksp=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17,
故答案为:10-17;
(3)某废液中含Zn2+,为提取Zn2+,先转化为沉淀,由图可知控制溶液pH的范围8.0~12.0,故答案为:8.0~12.0.
点评 本题考查难溶电解质的应用,为高频考点,把握图象应用、Ksp计算及混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意离子浓度的判断,题目难度不大.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
12.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | Fe2O3 | Al | 稀盐酸 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
8.下列烃的命名中,正确的是( )
| A. | 3-甲基-1-丁烯 | B. | 2-乙基丁烷 | ||
| C. | 2,3,3-三甲基丁烷 | D. | 3,4-二甲基丁烷 |
5.下列图示与对应的叙述不相符合的是( )
| A. |  表示燃料燃烧反应的能量变化 | |
| B. | 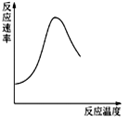 表示酶催化反应的反应速率随反应温度的变化 | |
| C. |  表示可逆反应从加入反应物开始建立化学平衡的过程 | |
| D. | 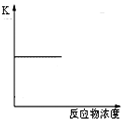 表示可逆反应的平衡常数随反应物浓度的变化 |
12.某地甲、乙两工厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-.若两厂单独排放污水都会造成较严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清的只含硝酸钠的溶液而排放,污染程度大大降低.根据所给信息有以下几种说法,你认为正确的是( )
| A. | Na+和NO3-来自同一工厂 | B. | Cl-和Fe2+一定来自同一工厂 | ||
| C. | SO42-和Cl-来自同一工厂 | D. | Ag+和Na+可能来自同一工厂 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下1.0L 0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| B. | 0.1mol ${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.3NA | |
| D. | 标准状况下,22.4LCl2参加反应,转移的电子数一定为2NA |
6.已知R2-有b个中子,核外有a个电子,表示R原子符号正确的是( )
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
 .
.