题目内容
一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )| A.4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ |
B.平衡时v正(O2)=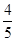 v逆(NO) v逆(NO) |
| C.平衡后降低压强,混合气体平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO含量降低 |
D
由于该反应为可逆反应,故反应达平衡时反应物不能全部转化为生成物,放出的热量小于905.9 kJ,A错误;根据速率之比等于化学计量数之比可知反应达平衡时,v正(O2)= v逆(NO),B错误;降低压强,平衡右移,气体的物质的量增大,但气体的质量不变,故混合气体的摩尔质量减小,C错误;升高温度,平衡左移,NO的含量降低,D正确。
v逆(NO),B错误;降低压强,平衡右移,气体的物质的量增大,但气体的质量不变,故混合气体的摩尔质量减小,C错误;升高温度,平衡左移,NO的含量降低,D正确。
 v逆(NO),B错误;降低压强,平衡右移,气体的物质的量增大,但气体的质量不变,故混合气体的摩尔质量减小,C错误;升高温度,平衡左移,NO的含量降低,D正确。
v逆(NO),B错误;降低压强,平衡右移,气体的物质的量增大,但气体的质量不变,故混合气体的摩尔质量减小,C错误;升高温度,平衡左移,NO的含量降低,D正确。
练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是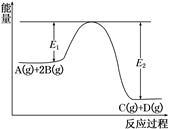
 xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图: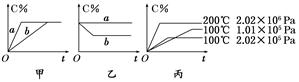
 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 ?C(g)+D(g)已达到平衡状态
?C(g)+D(g)已达到平衡状态  bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
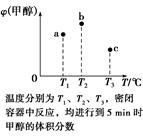
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( ) CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )