题目内容
16.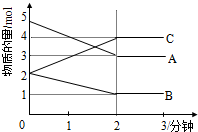 某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.
某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.
分析 从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;化学反应速率是单位时间内浓度的变化.
解答 解:由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,作为C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B?2C,
由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率.
故答案为:2A+B?2C;不能;不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.
点评 本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法.

练习册系列答案
相关题目
13.下列叙述中正确的是( )
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 元素的高价态化合物具有氧化性,低价态化合物具有还原性 | |
| C. | 失去电子越多的物质,还原性越强 | |
| D. | 当某元素由化合态变为游离态时,该元素发生还原反应 |
1.研究氮及其化合物的性质在人类进步过程中具有极为重要的意义.
(1)工业上消除氮的氧化物可采用以下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H
在温度为T1和T2时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①温度为T1℃时,0~20min内,v(CH4)=0.0125mol/(L.s).
②T1<T2(填“>”或“<”,下空同);△H<0,判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)的平衡常数表达式K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$,温度为T1℃时,K的值为6.4.
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小(填“增大”、“减小”或“不变”).
(2)已知反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.将一定量N2O4气体充入如图绝热容器一段时间后,压缩和拉伸活塞过程中气体的透光率(气体颜色越浅,透光率越大)随时间变化如图所示.
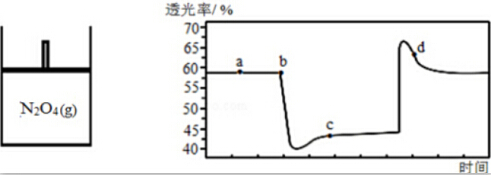
①a点与c点相比,c (NO2)更大的是c,体系温度更低的是a.
②d点,v正(NO2)>v逆(NO2)(填“>”、“<”或“=”).
③下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变.
(1)工业上消除氮的氧化物可采用以下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H
在温度为T1和T2时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
②T1<T2(填“>”或“<”,下空同);△H<0,判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)的平衡常数表达式K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$,温度为T1℃时,K的值为6.4.
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小(填“增大”、“减小”或“不变”).
(2)已知反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.将一定量N2O4气体充入如图绝热容器一段时间后,压缩和拉伸活塞过程中气体的透光率(气体颜色越浅,透光率越大)随时间变化如图所示.

①a点与c点相比,c (NO2)更大的是c,体系温度更低的是a.
②d点,v正(NO2)>v逆(NO2)(填“>”、“<”或“=”).
③下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变.
8.现有室温下的四种溶液,其pH如表所示,下列有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ②③两溶液等体积混合,所得溶液中:c(OH-)>c(H+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L④和V2L①溶液混合后,若pH=7,则V1<V2 |
5.下列化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
6.元素${\;}_{8}^{18}$O的原子核内中子数与质子数之差为( )
| A. | 8 | B. | 10 | C. | 2 | D. | 18 |
 (1)氨在国民经济中占有重要地位.
(1)氨在国民经济中占有重要地位.
 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1