题目内容
17. 实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )| A. | 只用盐酸一种试剂就可以确定该固体M的成分 | |
| B. | 往溶液中加入稀硝酸酸化的BaCl2溶液,若有白色沉淀生成,则固体M为Na2SO4 | |
| C. | 往溶液中通入二氧化碳,若有白色沉淀生成,则固体M为Na2SiO3 | |
| D. | 只用氯水一种试剂就可以确定该固体M的成分 |
分析 A、盐酸和Na2SO3反应会生成二氧化硫气体,与硫化钠反应生成硫化氢气体,和Na2SiO3反应会生成硅酸沉淀,和Na2SO4不反应;
B、亚硫酸钠中加硝酸酸化的BaCl2,会有硫酸钡沉淀生成;
C、二氧化碳通入Na2SiO3中可以获得硅酸白色沉淀;
D、氯水中含有氢离子、氯气单质等,据此解答即可.
解答 解:A、盐酸和Na2SO3反应会生成二氧化硫气体,有刺激性气味,和硫化钠反应生成硫化氢有臭鸡蛋气味的气体,和Na2SiO3反应会生成硅酸白色沉淀,和Na2SO4不反应,所以只用盐酸一种试剂就可以确定该固体M的具体成分,故A正确;
B、亚硫酸钠能被硝酸氧化为硫酸钠,所以加入硝酸酸化的BaCl2,若有沉淀,则固体M为Na2SO4或是Na2SO3,或二者的混合物,故B错误;
C、强酸可以制弱酸,碳酸酸性强于硅酸,二氧化碳通入Na2SiO3中可以获得硅酸白色沉淀,故C正确;
D、氯水中含有氯气单质,与Na2S生成淡黄色沉淀,含有氢离子,与Na2SO3和Na2SiO3分别生成气体和沉淀,与Na2SO4无现象,故只用氯水一种试剂就可以确定该固体M的成分,故D正确,故选B.
点评 本题是一道有关离子的检验题,要熟记常见离子的特征离子反应,是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.X、Y、Z、M、W 为五种短周期元素.X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成XZ2分子,Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的质子数是 X、Y、Z、M四种元素质子数之和的1/2.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
5.下列分子的电子式书写正确的是( )
| A. | 氨 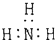 | B. | 四氯化碳 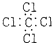 | C. | 氮 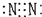 | D. | 二氧化碳 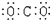 |
12.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g.
试写出:
(1)a微粒的原子结构示意图为
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a微粒的原子结构示意图为

(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
2.在标准状况下,mgA气体与ngB气体分子数相等,下列说法不正确的是( )
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
9.在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应.生成NO的物质的量( )
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
6.据报道,${\;}_{67}^{166}$Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |

 ;
;