��Ŀ����
����Ŀ���ӹ����������仯�������������������е����÷����˾�ı䡣
��.��1����Ԫ�������ڱ��е�λ��Ϊ _____ ��
��2���Ŵ��й��Ĵ���֮һ��ָ����������Ȼ��ʯ�Ƴɵģ�����Ҫ�ɷ��� ____ (����ĸ)��
a.Fe b.FeO c.Fe3O4 d.Fe2O3
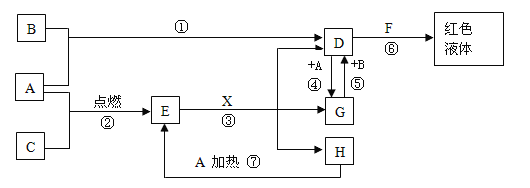
��.��ͼ��������������(��Ҫ�ɷ�ΪFe2O3��Fe3O4��SiO2)Ϊԭ���Ʊ��ߴ�����������������ʾ��ͼ��
�ش�����������
��1����������˺���ҺA�еĽ����������� ____ ��
��2������FeCO3���ɲ�Ʒ���Ļ�ѧ����ʽΪ______ ��
��3��д����������Ӧ�����ӷ���ʽ��______________ ��
���𰸡��������ڵ�����cFe3+��Fe2+(�������ӡ���������4FeCO3+O2�T2Fe2O3+4CO2Fe2++2HCO3-![]() �TFeCO3��+CO2+H2O
�TFeCO3��+CO2+H2O
��������
��. ��Ԫ�������ڱ���λ�ڵ������ڵڢ��壬�����ɷ���Ҫ��������������
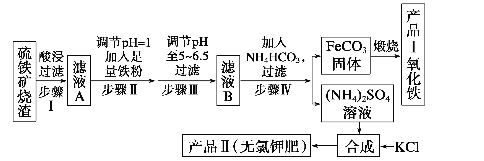
��.�ڿ����м�������SiO2�����ᷴӦ�����˺���������ΪSiO2����ҺA�м���������۽�Fe3+��ԭΪFe2+���ɼ��백ˮ������ҺpH��5~6.5�����˺�����ҺB�м���̼����刺�����FeCO3��Ӧ�������տɵ�Fe2O3���������Һ��KCl�ϳ����ȼط���������Դ˽��
��.��1����Ԫ�������ڱ���λ�ڵ������ڵڢ��壬
��2�������ɷ���Ҫ����������������ѡc��
��ˣ�������ȷ�������������ڵڢ��壻c��
��.��1��Fe2O3��Fe3O4��FeO����ϡ���ᷴӦ�õ�Fe2+��Fe3+��SiO2������ϡ���ᷴӦ��
�����������˺���ҺA�к��еĽ�����������Fe2+��Fe3+��
��ˣ�������ȷ������Fe2+��Fe3+��
��2��������ͼ����֪��������FeCO3���ɲ�Ʒ���������Ͷ�����̼��FeԪ�ػ��ϼ���������Ӧ����Ӧ����������ѧ����ʽΪ4FeCO3+O2![]() 2Fe2O3+4CO2��
2Fe2O3+4CO2��
��ˣ�������ȷ������4FeCO3+O2![]() 2Fe2O3+4CO2��
2Fe2O3+4CO2��
��3����ҺB�к�����������������NH4HCO3��Һ�����Ļ�ѧ����ʽΪFeSO4+2NH4HCO3=FeCO3��+CO2��+H2O����˲������Ӧ�����ӷ���ʽΪ��Fe2++2HCO3-= FeCO3��+CO2��+H2O��
��ˣ�������ȷ������Fe2++2HCO3-= FeCO3��+CO2��+H2O��

 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ���л��Ļ�ԴԶ������������ӻ�ѧ���ӽǿ����������ⲻ��ȷ���ǣ� ��
A | B | C | D |
ǧ�����������࣬������ɳʼ����������������ɳ��ʫ�� |
˾ĸ�춦 |
����(China) |
��°� |
ʫ���С��ԡ��������൱�ڷ����ᴿ�����еġ����ˡ� | ����ͭ��Ʒ�����ҹ��Ŵ��Ƽ���Գɾ͵Ĵ���֮һ | �������β�Ʒ��Chinaһ����ָ�����������ⷴӳ���������������й���Ϊ���������硱������ | �ҹ���ѧ��ҵ�ĵ���ˣ���Ҫ�ɾ�: �����Ƽ���ü�ָ�����ռ� |
A. A B. B C. C D. D