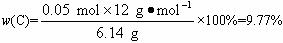题目内容
有某种碱金属元素组成的两种碳酸盐的混合物6.14 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到下图所示的曲线.
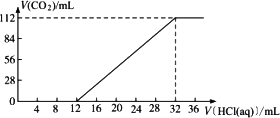
试计算:
(1)混合物中碳元素的质量分数.
(2)确定这两种碳酸盐的化学式.
(3)所滴加盐酸的物质的量浓度.
答案:
解析:
解析:
答案:(1)9.77% (2)K2CO3、KHCO3 (3)2.5 mol·L-1
思路解析:(1)
n(C)=n(CO2)=![]() =0.005 mol
=0.005 mol
6.14 g混合物中含有的n(C)=0.005 mol×10=0.05 mol
w(C)=![]() %=9.77%
%=9.77%
(2)混合物的平均摩尔质量![]() =122.8 g·mol-1
=122.8 g·mol-1
若M(M2CO3)=122.8 g·mol-1,则M(M)=31.4 g·mol-1
若M(MHCO3)=122.8 g·mol-1,则M(M)=61.8 g·mol-1
31.4 g·mol-1<M(K)<61.8 g·mol-1
所以碱金属元素是钾元素,两种碳酸盐的化学式:K2CO3、KHCO3
(3)n(K2CO3)+n(KHCO3)=0.05 mol
n(K2CO3)×138 g·mol-1+n(KHCO3)×100 g·mol-1=6.14 g
n(K2CO3)=0.03 mol n(KHCO3)=0.02 mol
n(K2CO3)-2n(HCl) n(KHCO3)-n(HCl)
0.03 mol 0.06 mol 0.02 mol 0.02 mol
所以n(HCl)=0.06 mol+0.02 mol=0.08 mol
c(HCl)=![]() =2.5 mol·L-1
=2.5 mol·L-1

练习册系列答案
相关题目