��Ŀ����
H2SO4�ǹ�ҵ�ϳ��õ��ᣬNH4Al(SO4)2��һ��ʳƷ�ӹ�ҵ�г��õ�ʳƷ���Ӽ������ڱ���ʳƷ��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1��NH4Al(SO4)2������ˮ������ԭ����_____________�������ӷ���ʽ˵������
��2��20��ʱ����Ϊ0.1mol L-1�ļ��ֵ������Һ��pH ���¶ȱ仯��������ͼ1 ��ʾ��

�� ���з���0.1mol��L-1 NH4Al(SO4)2��Һ��pH���¶ȱ仯��������_______�����������֣���
�� 20�� ʱ��0.1mol��L-1NH4Al(SO4)2��Һ�У�2c(SO42-)-c(NH4+)-3c(Al3+)=____mol��L-1����������ּ���ʽ�����ػ���
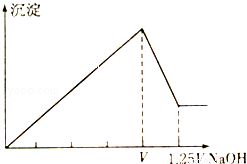
��3������ʱ����100mL0.1mol��L-1NH4HSO4��Һ�еμ�0.1mol L-1NaOH��Һ����ҺpH ��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ��a��b��c��d �ĸ��㣬ˮ�ĵ���̶�������__________�㣬��b�㣬��Һ�и�����Ũ���ɴ�С������˳����___________________��
��4��t�� ʱ��pH=2��ϡ�����pH=11��NaOH��Һ�������Ϻ���Һ�����ԣ�����¶���ˮ�����ӻ�����Kw=________________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���1����ҵ�ϳɰ�ʱ���ϳ�����ÿ����1molNH3���ų�46.1kJ��������
ijС���о���500���¸÷�Ӧ�����е������仯�����Ƿֱ��������ΪVL���������º����ܱ������м���һ�����ķ�Ӧ�ʹ������ͬ�¶��·�����Ӧ������������£�
���� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ�� | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1 min | �ų�������36.88kJ |
b | 2 | 8 | 0 | t2 min | �ų�������Q |
������a�У�0~t1ʱ���ƽ����Ӧ����Ϊ��(H2)= ___________��
������������ȷ����________������ĸ��ţ���
A������b�з�Ӧ��ƽ��״̬ʱ��Q��73.76kJ
B��ƽ��ʱ����������H2������������
C����Ӧ��ʼʱ���������з�Ӧ�Ļ�ѧ��Ӧ�������
D��ƽ��ʱ��������N2��ת���ʣ�a<b
��2����Ϊԭ�ϣ��ϳ����صķ�Ӧԭ��Ϊ��2NH3(g)��CO2(g) CO(NH2)2(l)��H2O(g) ��H = a kJ��mol-1��
CO(NH2)2(l)��H2O(g) ��H = a kJ��mol-1��
Ϊ�о�ƽ��ʱCO2��ת�����뷴Ӧ��Ͷ�ϱ�[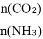 ]���¶ȵĹ�ϵ���о�С����10 L�����ܱ������н���ģ�ⷴӦ���������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����
]���¶ȵĹ�ϵ���о�С����10 L�����ܱ������н���ģ�ⷴӦ���������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����

��a_______0 (���������)��
����n(CO2)��ʼ =10 mol�����ߢ��Ͷ�ϱ�Ϊ0.4����100�������·�����Ӧ����ƽ����A�㣬��A������ʼѹǿ��Ϊ_______��
��A��ƽ�ⳣ����B��ƽ�ⳣ����Ĺ�ϵ��KA_______ KB (�������������)��
��3�����ð������������������ȡ����N2H4����ͼ���ɡ��������������γɵ���ɫȼ�ϵ�أ���ʯīΪ�缫�ĵ�ع���ԭ��ʾ��ͼ��b�缫Ϊ_______�����������������д���õ�ع���ʱa�缫�ĵ缫��Ӧʽ_______��
�ֱ�������±���ʾʵ�飬����ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ�� | ���� | ���� |
A | ��FeBr2��Һ�м���������ˮ���ټ� CCl4�� | CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
B | �������е�������NaAlO2��Һ | ���������� | AlO2-��H+δ������Ӧ |
C | ��ij��Һ��μ�NaOH��Һ����ʪ��ĺ�ɫʯ����ֽ�D���Թܿ� | ��ֽ��ɫ�� ���Ա仯 | ԭ��Һ����NH4+ |
D | �����£��ⶨ�����ʵ���Ũ�ȵ� Na2CO3��Na2SO3��Һ��pH | ǰ�ߵ�pH �Ⱥ��ߵĴ� | Ԫ�طǽ����ԣ�S��c |
A. A B. B C. C D. D
�����ڱ��������ڵڢ���Ԫ�أ��仯������;�㷺���磺LiCoO2��﮵�ص��������ϣ������ܿ�����ָʾ���ʹ����Ʊ���
��.��1��LiCoO2����Ԫ�صĻ��ϼ�Ϊ_______
��2����ҵ�Ͻ���﮵�ص��������������������Һ��ϡ�����ϼ��ȣ��ɵõ�CoSO4���գ���Ӧ�Ļ�ѧ����ʽΪ��______________�������������H2SO4��H2O2�Ļ��Һ����ȱ����____________
��.����һ�ֺ��ܿ�ʯ[��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO��]��ȡCoC2O4��2H2O�����������£�
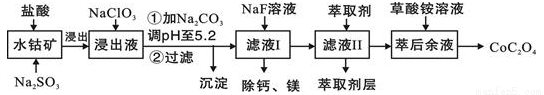
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH��2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��3������Һ�м�NaClO3��Ŀ���ǣ�______________��
��4������ƽ���ƶ�ԭ��˵����Na2CO3��pH��5.2���ó�����ԭ��____________
��5����Һ���м�����ȡ����������___________
��6�������ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp(MgF2)��7.35��10-11��Ksp(CaF2)��1.05��10-10�����������NaF��������Һc(Mg2+)/c(Ca2+)��___________��


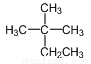 ��ϵͳ����Ϊ��2-��-2-�һ�����
��ϵͳ����Ϊ��2-��-2-�һ�����