题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
C
在酸性溶液中,NO3-能氧化Fe2+,选项A大量共存;选项B中溶液显酸性,AlO2-不能大量共存;C中溶液显碱性,可以大量共存;D中溶液可能显酸性,液可能显碱性。如果显酸性,在NO3-存在的条件下不能生产氢气。如果显碱性,可以大量共存,因此正确的答案选C。

练习册系列答案
相关题目
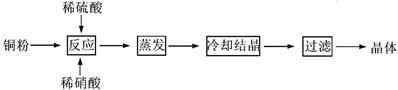
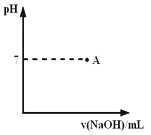
 。已知某澄清溶液常温下的AG=12,则在此溶液中能大量共存的离子组
。已知某澄清溶液常温下的AG=12,则在此溶液中能大量共存的离子组