题目内容
【题目】下列说法中正确的是 ( )
A. 干冰、液态氯化氢都是电解质
B. Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
C. 有单质参加或生成的反应不一定属于氧化还原反应
D. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
【答案】C
【解析】
A.二氧化碳为非电解质,故A错误;B.氧化铝与强酸、强碱反应都生成盐和水,为两性氧化物,故B错误;C.同素异形体之间的转化为非氧化还原反应,如氧气和臭氧,都有单质参加反应,但不是氧化还原反应,故C正确;D.根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,故D错误;故选C。

 黄冈天天练口算题卡系列答案
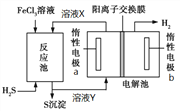
黄冈天天练口算题卡系列答案【题目】某课题组设计实验探究SO2的性质。

实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀。
(1)仪器R的名称是______________________。
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:______________________________________。
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2”的目的是___________________________。
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4↓ +2SO42-+2NO+4H+。
猜想2:通入少量的SO2,则发生反应的离子方程式为______________________。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中,__________ | ________________ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是_____(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH_____7(填“>”“<”或“=”)。