题目内容
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
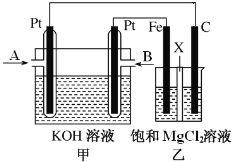
A.甲中A处通入CH4,电极反应式为CH4+10OH8e![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl+2H2O![]() Cl2↑+H2↑+2OH
Cl2↑+H2↑+2OH
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
【答案】C
【解析】
试题分析:A.乙为电解MgCl2溶液的装置,反应开始后观察到Fe电极附近出现白色沉淀,则氢离子在Fe极放电,所以Fe极为阴极,则甲中B处通入CH4,为负极,发生氧化反应,电极反应式为:CH4+10OH8e![]() +7H2O,故A错误;B.乙中电解MgCl2溶液的总反应为Mg2++2Cl+2H2O
+7H2O,故A错误;B.乙中电解MgCl2溶液的总反应为Mg2++2Cl+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故B错误;C.甲中每消耗标准状况下22.4 L CH4,转移8 mol电子,则乙中产生4 mol Cl2,故C正确;D.甲中KOH参与反应,pH减小,乙中氢离子放电,pH增大,故D错误;故选C。
Cl2↑+H2↑+Mg(OH)2↓,故B错误;C.甲中每消耗标准状况下22.4 L CH4,转移8 mol电子,则乙中产生4 mol Cl2,故C正确;D.甲中KOH参与反应,pH减小,乙中氢离子放电,pH增大,故D错误;故选C。

【题目】右图为浓硫酸与铜片反应的装置。

请回答:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性 |
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染 |
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 |
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况) |
【题目】亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:

① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。



