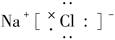题目内容
下列各组物质中,按熔点由低到高排列的是( )。
| A.O2、I2、Hg | B.CO2、Al2O3、KCl |
| C.Na、K、Rb | D.H2S、H2Se、H2Te |
D
A项可联系三种物质在常温下的状态判断,O2为气体,I2为固体,Hg为液体,熔点应为O2<Hg<I2;B项中CO2为气体,而KCl和Al2O3为离子化合物,在常温下均为固体,由离子半径K+>Al3+,Cl->O2-且后者电荷数高于前者,可知Al2O3的熔点应高于KCl;C项碱金属的熔、沸点随核电荷数增大而降低;D项中三种物质为氧族元素的气态氢化物,它们的相对分子质量依次增大,范德华力依次增大,熔点依次升高。

练习册系列答案
相关题目
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1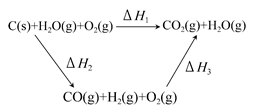

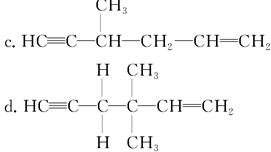
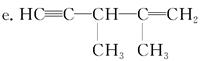
 ×946=315.3kJ·mol-1
×946=315.3kJ·mol-1