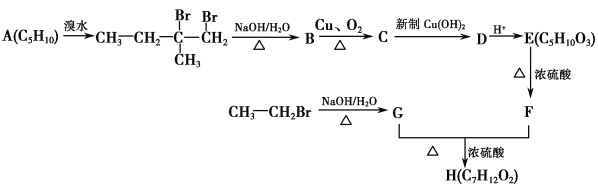
题目内容
【题目】下列说法正确的是( )
A. 所有共价键都有方向性
B. s轨道和p轨道重叠可以形成π键
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子之间形成共价键时,可形成多个σ键
【答案】C
【解析】A.s-s共价键没有方向性,可以任意方向重叠,故A错误;B.s轨道和p轨道只能头碰头重叠,形成σ键,而未参加杂化的p轨道可形成π键,故B错误;C.S最外层有6个电子,只能结合2个H,形成H2S分子,若写成H3S分子,违背了共价键的饱和性,故C正确;D.两个原子之间形成共价键时,形成单键、双键或三键时,只能存在1个σ键,故D错误;故选C。

练习册系列答案
相关题目