题目内容
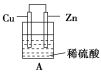
【题目】(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片(锌片和铜片不接触),可观察到铜片上________(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为________,正极的电极反应式为________________________。
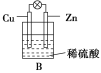
(2)如果烧杯中最初装入的是2 mol/L 500 mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中硫酸的物质的量浓度为(溶液体积变化忽略不计)____________________。
(3)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其主要原因是________________。
A.回收利用电池外壳的金属
B.防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C.防止电池中渗漏的电解液腐蚀其他物品
D.回收其中石墨电极
【答案】没有 锌 2H++2e-=H2↑ 1 mol/L B
【解析】
(1)金属铜和硫酸不反应,锌片、铜片和硫酸形成的原电池中,金属铜为正极,锌为负极;
(2)根据电极反应方程式来计算;
(3)废旧电池含有重金属离子,应防止重金属离子对土壤、水源的污染。
(1)稀硫酸和Zn发生置换反应生成氢气,在金属活动性顺序表中,Cu处于H的后面,Cu和稀硫酸不反应,所以铜片上没有气泡;用导线把锌片和铜片连接起来,组成一个原电池,锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;
(2)根据正极反应:2H++2e-=H2↑,当在标准状况下收集到11.2L,即0.5mol的氢气时,转移电子是1mol,消耗的氢离子物质的量为1mol,消耗硫酸0.5mol,则剩余硫酸的物质的量为2mol/L×0.5L0.5mol=0.5mol,所以剩余的硫酸的浓度c=![]() =
=![]() =1mol/L;
=1mol/L;
(3)废旧电池中含有汞、镉和铅等重金属离子,对人体有害,对土壤和水源的污染,不能随意丢弃,废旧电池集中处理主要考虑污染问题,答案选B。

 阅读快车系列答案
阅读快车系列答案