题目内容
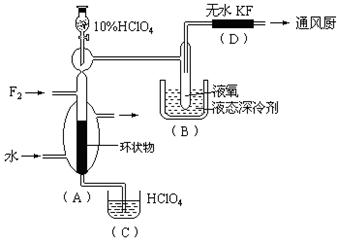
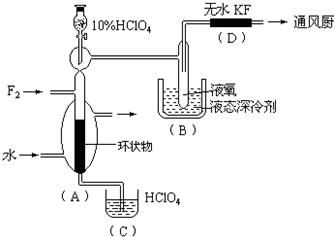
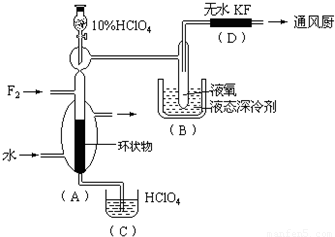
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃。李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
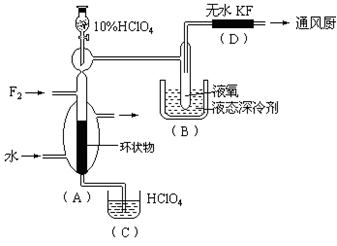
(1)实验中生成X的化学方程式是 ;
(2)现有10%和30%的HClO4,李明最好选用 ,理由是 ;
(3)B中冷却剂选用液氧的理由是 ;
(4)A中填充环状物的作用是 。
(1)HClO4+F2=ClO4F+HF (2)30%的HClO4,浓度增大,反应速率加快;(3)因为液氧提供的低温可以使ClO4F 成为固体,便于ClO4F 的分离;(4)增大F2与HClO4的接触面积,以提高反应速率,有利于反应朝预定方向进行。
解析:
依据题给信息来解答,由X中各元素的质量分数可推知X分子中各原子的数目比。熟练运用影响反应速率的因素解决问题。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
 已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答: