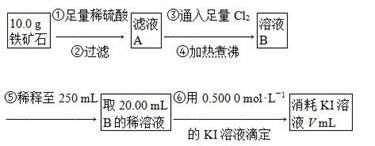
题目内容
( 14分)某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
(1)Na2O2中含有的化学键类型: ;请写出a中反应的化学方程式 。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O =" NaOH" + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中, ,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
① ;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |  |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… | ② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(14分)
(1)离子键、非极性共价键 (2分)
2Na2O2 + 2H2O = 4NaOH + O2 ↑ (2分)
(2)加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。 (2分)
(3)① 溶液中NaOH浓度较大,pH≥13 (2分)
(4)① 仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果。
(或 假设②不正确,假设③正确) (2分)
②溶液先变红,后褪色;加稀盐酸后,又出现红色,但随后褪色。 (2分)
(5)加入稀盐酸,会因发生中和反应而放热,使溶液温度升高。
解析试题分析:(1)Na2O2中含有的化学键类型有离子键、非极性共价键;Na2O2与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2 + 2H2O = 4NaOH + O2 ↑
(2)证明过氧化氢的存在,利用其在二氧化锰作催化剂的条件下发生分解反应,生成氧气来判断。操作步骤是加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。
(3)当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;所以① 的假设是溶液中NaOH浓度较大,pH≥13;
(4)实验1的现象说明①仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果;
实验3的结论说明Na2O2与水反应后的溶液(pH=14>13),所以滴加2滴酚酞先变红后褪色;加入盐酸使氢氧根离子浓度减小,又出现红色,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,所以最终溶液褪色。
(5)加水稀释不变红,加盐酸后变红,因为加盐酸后发生中和反应,中和反应是放热反应,体系温度升高,溶液红色出现。
考点:考查过氧化钠与水反应机理的探究,对实验现象的分析判断,化学方程式的书写

[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1 K2Cr2O7标准溶液bmL,则滤液中
c(Fe2+)= mol·L—1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 | B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 | D.用氨水调节pH=7 |
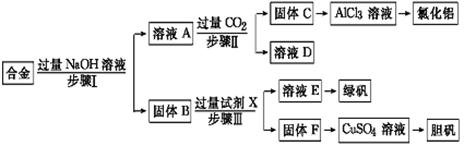
现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/LHNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3; 假设二:固体全部是Na2SO4;
假设三: 。
(2)设计实验方案(略);选用下图装置进行实验,该装置的优点是 。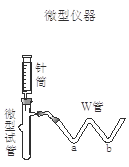
(3)进行实验:请在下表中用简要文字写出实验操作、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量固体样品于微型试管中;在W管a处滴入 、b处滴入 ;用胶管将W管与微型试管连接好 | |
| 步骤2:用针筒吸入 ,将针头穿过微型试管的胶塞,向固体样品中注入该溶液。 | 。 |
| 步骤3:拨出针筒,吸入蒸馏水洗净;再吸入 注入微型试管中 | 。 |
(4)若将上述探究过程中生成的气体通入到足量的新制漂白粉浓溶液中,则可生成白色沉淀。试写出该反应的离子方程式: 。
(5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
回答下列问题:
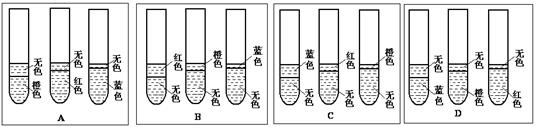
(1)根据你已有的对乙酸乙酯反应条件的认识,该实验预期可观察到的现象是下图中的 。
(2)该实验对反应温度的控制较为严格,若温度过高时,产生的主要问题是 。
(3)在步骤二中,振荡试管后可观察到液体稍显浑浊,其原因是 。
(4)按所设步骤实验反应速率较慢,其主要原因是 。
(5)在实际操作中,针对(4)中的原因进行改进后,预期的现象仍不明显,有人又将该实验作如下改进
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
| A.蔬菜表面洒少许福尔马林,可保鲜和消毒 |
| B.绿色食品就是不使用化肥农药,不含任何化学物质的食品 |
| C.推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质 |
| D.推广使用煤液化技术可减少二氧化碳温室气体气体的排放 |
下面不属于居室污染物的是
 |  |  |  |
| 消毒液、苯酚 | 尼古丁、二氧化氮 | 甲醛、二甲苯 | 一氧化碳、二氧化硫 |
| A | B | C | D |