题目内容
(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、N H4C1等物质
H4C1等物质 溶解度的差异,以食
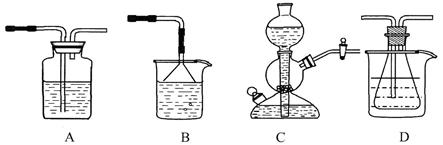
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
( 5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
 H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
| | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2[ 来源:Z|xx| 来源:Z|xx| | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答以下问题:
(1)装置的连接顺序应是 (填字母)。
(2)A装置中盛放的试剂是 ,其作用是 。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是 。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)
(
 5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。(1)CADB(2分)
(2)饱和NaHCO3溶液(1分) 除去CO2中的HCl (1分)
(3)温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行(2分)
(4)NaCl、NH4C1、NH4HCO3(2分)
(5)NaHCO3、NaCl、NH4C1、NH4HCO3(1分) 结晶( 1分)
1分)
(2)饱和NaHCO3溶液(1分) 除去CO2中的HCl (1分)
(3)温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行(2分)
(4)NaCl、NH4C1、NH4HCO3(2分)
(5)NaHCO3、NaCl、NH4C1、NH4HCO3(1分) 结晶(
 1分)
1分)略

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目

 漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若 ,说明装置不漏气。
漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若 ,说明装置不漏气。 由是 。
由是 。 。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在
。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在 同周期中最小。
同周期中最小。 ,Z 。
,Z 。 时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式)。
时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式)。 学式)。
学式)。