题目内容
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
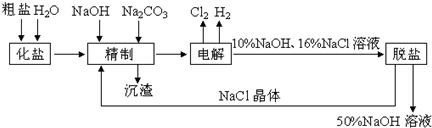
(1)在电解过程中,与电源正极相连的电极上电极反应为
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加Na2CO3,后加NaOH,再加钡试剂.

(1)在电解过程中,与电源正极相连的电极上电极反应为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,与电源负极相连的电极附近,溶液pH升高
升高
(选填“不变”、“升高”或“下降”).(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
.(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
ac
ac
.a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
b
b
(选填a、b、c)a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加Na2CO3,后加NaOH,再加钡试剂.
分析:(1)电解食盐水,与正极相连为阳极,生成氯气,与电源负极相连为阴极,生成氢气和NaOH;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后.
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后.
解答:解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,故答案为:ac;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然只有选项b符合,故答案为:b.
故答案为:2Cl--2e-═Cl2↑;升高;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,故答案为:ac;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然只有选项b符合,故答案为:b.
点评:本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
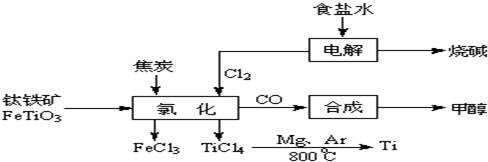
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是: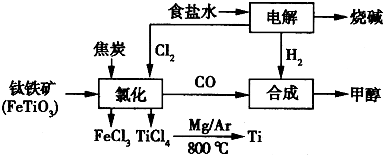
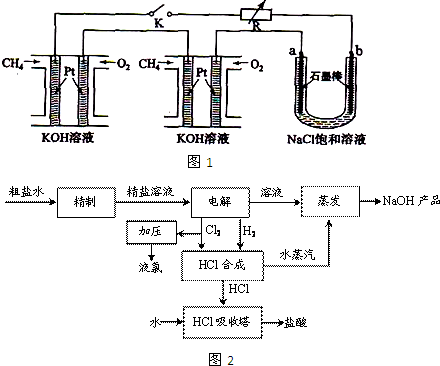



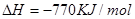
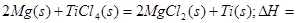 ____________
____________

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________