题目内容
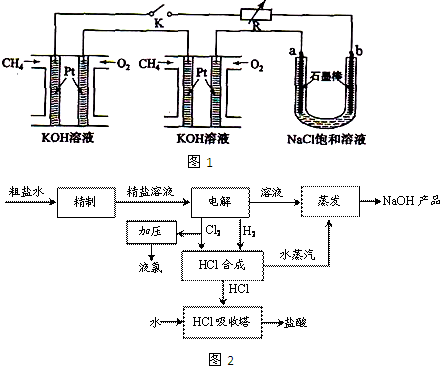
氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:(1)精制过程中反应的离子方程式为______.
(2)电解过程的总反应方程式为______ 2NaOH+H2↑+Cl2↑

【答案】分析:(1)精制过程就是将杂质离子转化为沉淀除去的过程;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气;
(3)电解池中阳极是阴离子发生失电子的氧化反应,根据氯气的用途来回答;
(4)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法.
解答:解:(1)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即Ba2++SO42-=BaSO4↓,加入氢氧化钠,可以将杂质离子镁离子除去,即Mg2++2OH-=Mg(OH)2↓,加入碳酸铵,即可以将杂质钙离子除去,还可以将多余的钡离子除去,即Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气,电解反应方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)电解池中阳极是氯离子发生失电子的氧化反应生成氯气的过程,氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,
故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种);
(4)根据表中数据可以得出:氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,固始县氢氧化钠和氯化钠分离的方法是:蒸发浓缩结晶的过程,脱盐后的碱液中会含有氯化钠晶体,因为发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动,
故答案为:蒸发;浓缩;蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解).
点评:本题是一道化学和工业生产相结合的知识题目,考查的知识点较多,是一道综合题目,难度不大.
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气;
(3)电解池中阳极是阴离子发生失电子的氧化反应,根据氯气的用途来回答;
(4)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法.
解答:解:(1)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即Ba2++SO42-=BaSO4↓,加入氢氧化钠,可以将杂质离子镁离子除去,即Mg2++2OH-=Mg(OH)2↓,加入碳酸铵,即可以将杂质钙离子除去,还可以将多余的钡离子除去,即Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气,电解反应方程式为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; (3)电解池中阳极是氯离子发生失电子的氧化反应生成氯气的过程,氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,
故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种);
(4)根据表中数据可以得出:氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,固始县氢氧化钠和氯化钠分离的方法是:蒸发浓缩结晶的过程,脱盐后的碱液中会含有氯化钠晶体,因为发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动,
故答案为:蒸发;浓缩;蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解).
点评:本题是一道化学和工业生产相结合的知识题目,考查的知识点较多,是一道综合题目,难度不大.

练习册系列答案
相关题目
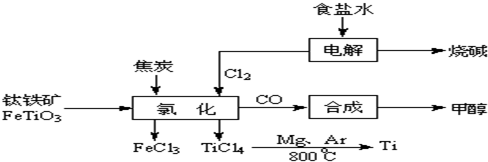
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:




 ____________
____________

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________