题目内容
7.某原电池装置如图所示,下列说法正确的是( )
| A. | Zn棒作原电池的正极 | B. | Cu棒的质量逐渐增大 | ||
| C. | Zn棒处的电极反应式:Zn-2e-=Zn2+ | D. | 该装置能将电能转化为化学能 |
分析 在用锌片、铜片和硫酸铜组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上铜离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答.
解答 解:A.锌片作负极,铜活泼性较锌弱,为原电池的正极,故A错误;
B.铜电极上析出铜,电极质量逐渐增大,故B正确;
C.锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,Zn-2e-=Zn2+,故C正确;
D.原电池是化学能转化为电能的装置,故D错误;
故选BC.
点评 本题考查原电池知识,为高考高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意把握原电池的组成以及工作原理,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
19.下列关于组成表示为CxHy的烷、烯、炔烃的说法不正确的是( )
| A. | 当x≤4 时,常温常压下均为气体 | |
| B. | 一定存在y≤2x+2 | |
| C. | 完全燃烧的通式为CxHy+(x+$\frac{y}{4}$) O2→x CO2+$\frac{y}{2}$ H2O | |
| D. | 等质量的烷、烯、炔烃完全燃烧,碳的质量分数越大耗氧量越多 |
16.下列叙述正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素周期表中的所有元素都是从自然界中发现的,过渡元素都是金属元素 | |
| C. | 非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构 | |
| D. | 第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物 |
2.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA | |
| B. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| C. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.01NA | |
| D. | 10mL5mol/L(NH4)2SO4溶液中含有NH+4数目为0.2NA个 |
19.下列原子结构示意图表示的元素与 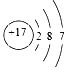 的元素同主族的是( )
的元素同主族的是( )
 的元素同主族的是( )
的元素同主族的是( )| A. |  | B. |  | C. |  | D. |  |
16.化学与生产、生活密切相关.下列叙述错误的是( )
| A. | 料酒可以除去食物中的腥味 | |
| B. | 裂化汽油可用于萃取碘水中的碘单质 | |
| C. | 葡萄糖可用于补钙药物的合成 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
19.下列关于化学反应与能量的说法中正确的是( )
| A. | 中和反应要吸收能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 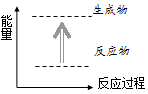 如图所示的反应为放热反应 | |
| D. | 化学键断裂放出能量,化学键生成吸收能量 |

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$

 .
. 、
、 ;
;