题目内容
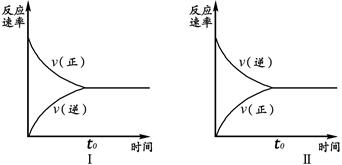
425℃时,在两个相同的密闭容器中进行反应H2+I2?2HI并达到平衡,得到图象分别如(Ⅰ)、(Ⅱ)所示,下列说法不正确的是( )


| A、平衡时两容器中相应各成分的百分含量相同,属于等效平衡 | B、图(Ⅰ)所示平衡时H2(或I2)的转化率为79% | C、两容器中起始加入的物质相同,平衡时达到了相同的平衡状态 | D、平衡时两容器中H2、I2和HI的物质的量之比均为21:21:158 |
分析:同容积的定容密封容器,(I)中加入H2和I2各1mol,(II)中加入HI2mol,由于(II)按化学计量数转化到左边,可以得到H2和I2各1mol,所以达到平衡时两个容器内的平衡是等效的,故压强、浓度、转化率、含量均相同,结合图象分析解答.
解答:解:同容积的定容密封容器,(I)中加入H2和I2各1mol,(II)中加入HI2mol,由于(II)按化学计量数转化到左边,可以得到H2和I2各1mol,所以达到平衡时两个容器内的平衡是等效的,故压强、浓度、转化率、含量均相同;
A、两容器内的平衡属于等效平衡,所以平衡时两容器中相应各成分的百分含量相同,故A正确;
B、由图可知,达平衡时反应的H2(或I2)的物质的量为1-0.21=0.79mol/L,所以转化率为
×100%=79%,故B正确;
C、由图象可知,初始时(I)中加入H2和I2各1mol,(II)中加入HI2mol,故C错误;
D、达平衡时为等效平衡,两个平衡中物质的浓度分别相同,由图象可知,平衡时H2、I2和HI的浓度分别为0.21mol/L,0.21mol/L,1.58mol/L,所以两容器中H2、I2和HI的物质的量之比均为21:21:158,故D正确;
故选C.
A、两容器内的平衡属于等效平衡,所以平衡时两容器中相应各成分的百分含量相同,故A正确;
B、由图可知,达平衡时反应的H2(或I2)的物质的量为1-0.21=0.79mol/L,所以转化率为
| 0.79 |
| 1 |
C、由图象可知,初始时(I)中加入H2和I2各1mol,(II)中加入HI2mol,故C错误;
D、达平衡时为等效平衡,两个平衡中物质的浓度分别相同,由图象可知,平衡时H2、I2和HI的浓度分别为0.21mol/L,0.21mol/L,1.58mol/L,所以两容器中H2、I2和HI的物质的量之比均为21:21:158,故D正确;
故选C.
点评:本题考查了等效平衡知识,转化率的计算等,难度中等,注意理解等效平衡规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
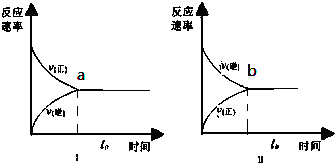
 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示: