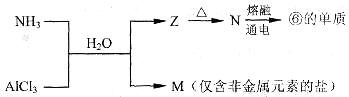
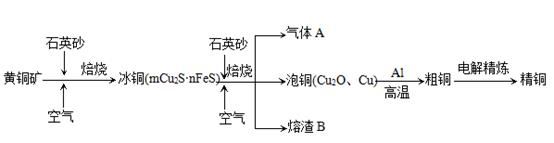
题目内容
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
D
解析试题分析:A、碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂,正确;B、NH4HCO3受热易分解,选择较低温度,正确;C、(NH4)2Fe(SO4)2如果被氧化会生成三价铁,用KSCN溶液检验变红,正确;D、(NH4)2Fe(SO4)2冷却结晶析出,说明它的溶解度小,错误。
考点:考查铁的化合物的性质、化工生产原理

下列有关铁元素的叙述中正确的是 ( )
| A.Fe(OH)2易被氧化生成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3 |
| B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI→FeI3+3H2O |
| D.铁元素位于周期表的第五周期第VIII族 |
一些不法商人在面粉生产中添加过氧化钙(CaO2)等添加剂对食品进行增白。下列关于过氧化钙(CaO2)的叙述正确的是
| A.CaO2中阴、阳离子的个数比为1:1 |
| B.CaO2对面粉增白原理与SO2漂白原理相似 |
| C.CaO2和水反应时,每产生1 molO2转移电子4 mol |
| D.CaO2放入NaHCO3溶液中,会放出二氧化碳,并产生白色浑浊 |
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
| A.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物充分加热,得b克固体 |
| D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
当0.2mol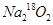 足量CO2完全反应后所得固体的质量为( )
足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。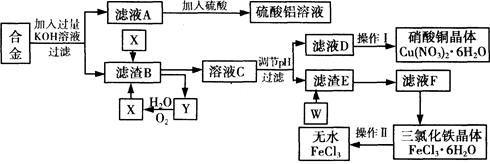
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
(6)写出滤渣E与W反应的化学方程式: 。