题目内容
【题目】根据阿伏加德罗定律判断,下列叙述不正确的是 ( )
A. 同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,同温同压下甲和乙的密度之比为1∶2
B. 同温同体积下等质量的CO和N2的压强之比为1∶1
C. 某温度T下,压强为2个大气压时,一定量 C2H4 的体积和其在标况下的体积相等,则T=546K
D. 同温同压下等质量的H218O和D216O所含原子数相等
【答案】A
【解析】A. 同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,则物质的量之比为1:2,因此摩尔质量之比为![]() :
: ![]() =1:1,则同温同压下甲和乙的密度之比等于摩尔质量之比为1∶1,故A错误;B. 等质量的CO和N2的物质的量相等,同温同体积下气体的压强之比等于物质的量之比为1∶1,故B正确;C. 根据PV=nRT,则T=
=1:1,则同温同压下甲和乙的密度之比等于摩尔质量之比为1∶1,故A错误;B. 等质量的CO和N2的物质的量相等,同温同体积下气体的压强之比等于物质的量之比为1∶1,故B正确;C. 根据PV=nRT,则T=![]() ,因此
,因此![]() =
=![]() :
:![]() =1:2,则T=2T0=546K,故C正确;D. H218O和D216O的摩尔质量相等, 同温同压下等质量的H218O和D216O的物质的量相等,原子数相等,故D正确;故选A。
=1:2,则T=2T0=546K,故C正确;D. H218O和D216O的摩尔质量相等, 同温同压下等质量的H218O和D216O的物质的量相等,原子数相等,故D正确;故选A。
点晴:本题考查了阿伏伽德罗定律及其推论,要熟记以下有用的推论:(1)同温同压时:①V1:V2=n1:n2=N1:N2 ②ρ1:ρ2=M1:M2 ③同质量时:V1:V2=M2:M1;(2)同温同体积时:④P1:P2=n1:n2=N1:N2 ⑤同质量时:P1:P2=M2:M1;(3)同温同压同体积时:⑥ρ1:ρ2=M1:M2=m1:m2。

 名校课堂系列答案
名校课堂系列答案【题目】氨的合成是人类科学技术上的一项重大突破。其原理如下:
N2( g) +3H2( g) ![]() 2NH3( g) △H= -92.4kJ/mol
2NH3( g) △H= -92.4kJ/mol
据此回答下列与NH3有关的问题:
(1)该反应的化学平衡常数表达式为K =_________ 。
(2)①500℃时,若把10molN2与20molH2置于体积为10L的密闭容器内,测得容器内压强随时间的变化关系如下表:
压强/MPa | 9.6 | 8.4 | 7.6 | 7.0 | 6.4 | 6.4 | 6.4 | 6.4 |
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
则从反应开始到平衡这段时间内,v(H2)=_________mol/(L·min)。若达到平衡后,再充人5mol N2与10molH2,再次达到平衡时NH3的体积分数与原平衡状态相比_____(填“增大”“减小”或“不变”)。
②合成氨反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_____(填“A”或“B”);比较p1、p2的大小关系:_____________。
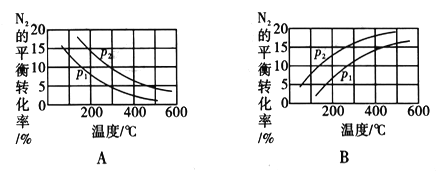
③某温度下,在恒压的某密闭容器中投入等物质的量的N2和H2,一段时间后测得H2的体积分数为40%,之后保持不变,则达到平衡时H2的转化率为________________。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料,与水在一定条件下可以生成氨气:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
是______(填序号)。
a.从反应开始到达到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
c.降低温度使尿素的转化率减小
d.恒温恒容时,向平衡体系中再充人少量氨气,平衡常数减小
(4)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb=_____________。(用含a的代数式表示)