题目内容
应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱

B
试题分析:根据元素周期律可以判断,碱金属单质的熔点随原子序数的增大而降低;砹的非金属性弱于氯,所以HAt的稳定性小于HCl,硒的非金属性弱于硫,所以硒的最高价氧化物对应水化物的酸性弱于硫酸;NH3的水溶液呈碱性;Tl与铝同族,但是金属性比铝强,所以其单质只能与盐酸反应,不能与氢氧化钠反应;同周期元素从左到右金属性逐渐减弱,最高价氧化物对应水化物的碱性也逐渐减弱。答案选B。
点评:元素的性质随着原子序数的递增而呈现周期性的变化,称为元素周期律。元素周期律需要熟练记住,但关键是利用好元素周期律解决实际问题。

练习册系列答案
相关题目
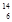 C原子的说法正确的是 ( )
C原子的说法正确的是 ( )
