题目内容
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
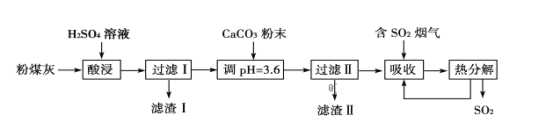
(1)酸浸时反应的化学方程式为_______。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为:Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为______(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是_______(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是______;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将_______(填“增大”“减小”或“不变”)。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O CaSO4 3CaCO3+2Al3++3SO42-+3H2O=2Al(OH)3+3CaSO4+3CO2↑ 溶液中的部分SO32-不稳定,易被氧化生成SO42- 减小
【解析】
粉煤灰(主要含Al2O3、SiO2等)和稀硫酸混合,Al2O3与硫酸发生反应Al2O3+3H2SO4=Al2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤溶液得滤渣Ⅰ为SiO2,滤液中含有Al2(SO4)3,调节pH=3.6,加入CaCO3粉末,发生反应CaCO3+2H+=Ca2++CO2↑+H2O,Ca2+与溶液中的SO42-结合形成CaSO4为微溶物,所以滤渣Ⅱ的成分主要为CaSO4,过滤得滤液Ⅱ,二氧化硫和水反应生成的H2SO3易被氧化生成H2SO4,H2SO4电离产生SO42-,再结合题目分析解答。
(1) 酸浸时粉煤灰中的Al2O3和稀硫酸混合,发生反应Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)SiO2是酸性氧化物,和稀硫酸不反应,过滤得滤渣Ⅰ为SiO2,滤液中含有Al2(SO4)3,调节pH=3.6,加入CaCO3粉末,发生反应CaCO3+H2SO4=CaSO4+CO2↑+H2O,CaSO4为微溶物,所以滤渣Ⅱ的成分主要为CaSO4;若溶液的pH偏高,溶液中的Al3+和OH-离子反应生成Al(OH)3,所以将会导致溶液中铝元素的含量降低,反应方程式为3CaCO3+2Al3++3SO42-+3H2O=2Al(OH)3+3CaSO4+3CO2↑;
(3)SO2被吸收后,二氧化硫和水反应生成的H2SO3易被氧化生成H2SO4,H2SO4电离产生SO42-,所以流程中经完全热分解放出的SO2量总是小于吸收的SO2的量,加热分解后的溶液中SO42-浓度增大,促进生成Al2(SO4)x(OH)6-2x,则溶液的酸性增强,溶液的pH减小。