题目内容
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:

(1)e在周期表中的位置是________,a的某种氢化物的相对分子质量是28,该氢化物的电子式为_____________。
(2)c、d、e元素的离子半径由大到小的顺序为___________(用离子符号表示);写出一个能说明f的非金属性强于e的化学方程式___________。
(3)b与氢元素按原子数2和4构成分子A的结构式为________,A是一种常用的还原剂。向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式______。b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为______。
(4)写出c、d两种元素形成的阴、阳离子数目比为1∶2的所有化合物的名称________。
(5)在100 mL b的最高价氧化物对应水化物和e的最高价氧化物对应水化物的物质的量浓度分别为0.3 mol·L-1和0.15 mol·L-1的混合液中加入2.56 g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度为______。
a.0.15 mol·L-1 b.0.225 mol·L-1
c.0.30 mol·L-1 d.0.45 mol·L-1
练习册系列答案
相关题目


 H2 (g)+CO2(g) △H<0。
H2 (g)+CO2(g) △H<0。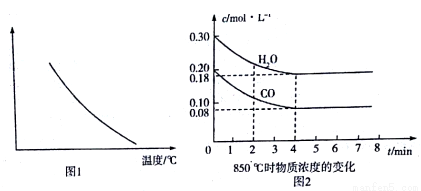
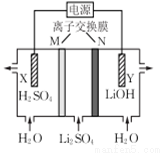
 CuSO4(aq)
CuSO4(aq) Cu
Cu NaHCO3
NaHCO3 Na2CO3
Na2CO3 Mg(OH)2
Mg(OH)2 Mg
Mg N2
N2 HNO3
HNO3 Pt
Pt

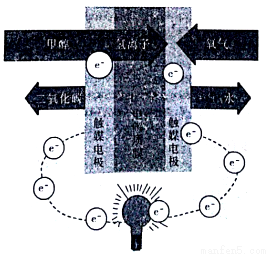
 分子结构的下列叙述中正确的是
分子结构的下列叙述中正确的是