题目内容
(18分)硫代硫酸钠在工业生产中用途非常广泛。
(1)Na2S2O3溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:
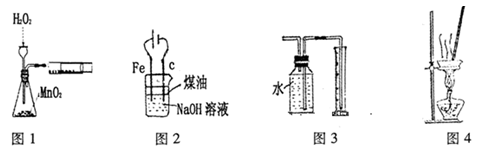
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:

①装置B的作用是检验装置A中SO2的吸收效率,则B中试剂是________________,表明SO2吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的Na2CO3含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。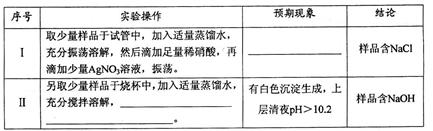
(1)Na2S2O3溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:
2Na2S+Na2CO3+4SO2
 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
①装置B的作用是检验装置A中SO2的吸收效率,则B中试剂是________________,表明SO2吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的Na2CO3含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。

(1)500mL容量瓶、胶头滴管(2分)
(2)①品红或溴水或KMnO4溶液(2分,其他合理答案也给分)溶液颜色很快褪去(2分)
②2NaOH+CO2 ="=" Na2CO3+H2O (3分)c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)(3分)
③Ⅰ.有白色沉淀生成 Ⅱ.加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH(3分)
(2)①品红或溴水或KMnO4溶液(2分,其他合理答案也给分)溶液颜色很快褪去(2分)
②2NaOH+CO2 ="=" Na2CO3+H2O (3分)c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)(3分)
③Ⅰ.有白色沉淀生成 Ⅱ.加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH(3分)
试题分析:(1)实验室需用480mL一定浓度的Na2S2O3溶液,根据实验步骤确定仪器,溶解用到烧杯和玻璃棒,移液要用到容量瓶,实验室中没有480mL的容量瓶,故应选500mL的容量瓶,定容需要胶头滴管;答案为:500mL的容量瓶、胶头滴管;(2)①二氧化硫具有还原性、漂白性,装置B的作用是检验装置A中SO2的吸收效率,则B中试剂可以用品红溶液、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液褪色,答案为:品红、溴水或KMnO4溶液;溶液颜色很快褪色;②根据题给反应知,进入装置C中的气体一定含有二氧化碳,C中溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是2NaOH+CO2 ="=" Na2CO3+H2O;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)。③实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除Na2CO3和NaOH干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,答案为:Ⅰ.有白色沉淀生成 Ⅱ.加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH。

练习册系列答案
相关题目