题目内容
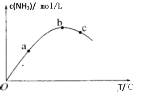
【题目】如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )

A.CaCO3(s)![]() Ca2+(aq)+CO32—(aq) ΔH<0
Ca2+(aq)+CO32—(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25 ℃时CaCO3的Ksp=2.8×10-9
D.温度不变,挥发水分,可使溶液由a点变到c点
【答案】C
【解析】
A.由图可知,温度越高,Ca2+、CO32-的浓度越大,因为溶解平衡为吸热反应,则CaCO3(s)Ca2+(aq)+CO32-(aq)△H>0,故A错误;
B.Ksp与温度有关,则图中只有b、c点对应的溶度积Ksp相等,故B错误;
C.由c点c(Ca2+)=2.0×10-5mol/L、c(CO32-)=1.4×10-4mol/L可知,25℃时,CaCO3的Ksp=c(Ca2+)c(CO32-)=2.8×10-9,故C正确;
D.由a点变到c点CO32-的浓度不变,而蒸发时溶剂减少,蒸发使离子浓度变大,不能实现,故D错误;
故选C。

 每课必练系列答案
每课必练系列答案【题目】某小组探究元素周期律性质递变规律,设计如下实验。

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:____。装置B所盛试剂是_____,其作用是_____;C中反应的离子方程式是_____________。
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是_____。
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有____、______胶头滴管玻璃片、试管。
(2)请完成下列表格
实验方案 | 实验现象 | 化学方程式 |
① | A | 2Na +2H2O=2NaOH +H2↑ |
② | ____ | ____ |
③ | E | Mg +2HCl=MgCl2 +H2↑ |
④ | D | 2Al +6HC1=2AlCl3 +H2↑ |
⑤ | ____ | ____ |
(3)由实验得出有关元素周期律结论:_________。