题目内容
(J4分)
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)已知锰元素的常见化合价为+7、+6、+4、+2,写出圆底烧瓶中反应的化学方程式
。
(2)A中m管的作用是 ,装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与Mn0:混合加热生成氯气,稀盐酸与Mn0:混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.Mn02与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
(1)MnO2+4HCl(浓)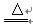 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)连通烧瓶和分液漏斗,平衡压强,使分流漏斗中液体顺利流下,防止G中溶液倒吸到E中
(3)饱和食盐水
(4)2Fe2++Cl2=2Fe3+2Cl-;溶液变蓝
(5)①探究c(Cl-)的影响;探究c(H+)的影响
②c(H+)大小
解析


