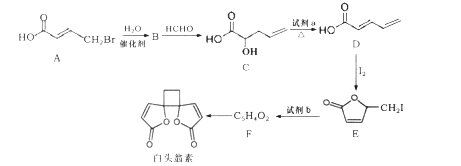
��Ŀ����
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��2H2��g��+O2��g��=2H2O��l����H=��570 kJ![]()
��2H2O��g��=2H2��g��+O2��g����H=+483.6kJ![]()
��2C��s��+O2��g��=2CO��g����H=��220.8 kJ![]()
��C��s��+O2��g��=CO2��g����H=��393.5 kJ![]()
�ش��������⣺
��1��������Ӧ���������ȷ�Ӧ����_______����д��ţ���
��2��H2��ȼ����Ϊ________��
��3��ȼ��10 g H2����Һ̬ˮ���ų�������Ϊ________��
��4��CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ______________________��
��5��H2O��l��=H2O��g����H=__________��
���𰸡��� 285 kJmol-1 1 425 kJ CO��g��+![]() O2��g��=CO2��g����H=��283.1 kJmol-1 +43.2 kJmol-1
O2��g��=CO2��g����H=��283.1 kJmol-1 +43.2 kJmol-1
��������
��1���ʱ����0��Ϊ���ȷ�Ӧ��
��2��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ʱ�ų���������
��3�������Ȼ�ѧ����ʽ������
��4����˹���ɵ�Ӧ����
��5����˹���ɵ�Ӧ����
��1��������Ӧ��ֻ�Тڵ��ʱ�����㣬�������ȷ�Ӧ��
��ȷ�𰸣��ڡ�
��2��2H2��g��+O2��g��=2H2O��l����H=��570 kJ��mol-1������ȼ���ȵĶ��壬ȼ����Ϊ570 kJ��mol-1/2=285kJ��mol-1��
��ȷ�𰸣�285kJ��mol-1��
��3��n��H2��=![]() =5mol�������Ȼ�ѧ����ʽ��
=5mol�������Ȼ�ѧ����ʽ��
2H2��g��+O2��g��=2H2O��l����H=��570 kJ![]()
2mol 570kJ
5mol Q
Q=![]() =1425 kJ ��ȼ��10 g H2����Һ̬ˮ���ų�������Ϊ1425 kJ��
=1425 kJ ��ȼ��10 g H2����Һ̬ˮ���ų�������Ϊ1425 kJ��
��ȷ����1425 kJ��
��4��2C��s��+O2��g��=2CO��g����H=��220.8kJ��mol-1 ��
C��s��+O2��g��=CO2��g����H=��393.5kJ��mol-1 ��
���ݸ�˹���ɢ�-�ۡ�1/2��CO��g��+![]() O2��g��=CO2��g����H=��283.1 kJmol-1��
O2��g��=CO2��g����H=��283.1 kJmol-1��
��ȷ����CO��g��+![]() O2��g��=CO2��g����H=��283.1 kJmol-1��
O2��g��=CO2��g����H=��283.1 kJmol-1��
��5��2H2��g��+O2��g��=2H2O��l����H=��570 kJ��mol-1 ��
2H2O��g��=2H2��g��+O2��g����H=+483.6 kJ��mol-1 ��
���ݸ�˹���ɣ���+ �ڣ�/2�ã�H2O��g��=H2O��l����H=-43.2 kJmol-1����H2O��l��=H2O��g����H=+43.2 kJmol-1��
��ȷ����+43.2 kJmol-1��

����Ŀ������������Ͷ������ǻ۵Ľᾧ�������й���ͳ��������ڱ��ݹ������漰��ѧ�仯����
A | B | C | D |
���� | ������ | ��ֽ | ֯�� |
|
|
|
|
��������֯���� ����ͼ�� | ���ۻ�����ˮ���� ���У��Ž����� | �ü�����̵���ֽ�ϼ��̻��� | ���Ứ��֯��ͼ�� |
A. AB. BC. CD. D