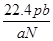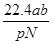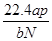题目内容
(10分)将25.0g胆矾(CuSO4·5H2O)溶于水配成200mL溶液,其密度为1.25g/cm3,试计算
(1)该溶液中CuSO4的质量分数为 ,SO42-的物质的量浓度为
(2)从该溶液中取出20mL加水稀释到100mL,稀释后的溶液中CuSO4的物质的量浓度为
(3)向稀释后的溶液中加入100mL1mol/L的NaOH溶液可生成沉淀的质量为 此时溶液中的溶质是 (填化学式)
(1)该溶液中CuSO4的质量分数为 ,SO42-的物质的量浓度为
(2)从该溶液中取出20mL加水稀释到100mL,稀释后的溶液中CuSO4的物质的量浓度为
(3)向稀释后的溶液中加入100mL1mol/L的NaOH溶液可生成沉淀的质量为 此时溶液中的溶质是 (填化学式)
(10分;每空2分) (1)6.4% 0.5mol/L
(2)0.1mol/L (3)0.98g NaOH和Na2SO4
(2)0.1mol/L (3)0.98g NaOH和Na2SO4
考查物质的量浓度的有关计算。
(1)溶液的质量是200ml×1.25g/ml=250g,溶质硫酸铜的质量是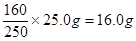 ,所以溶液中硫酸铜的质量分数是
,所以溶液中硫酸铜的质量分数是 ;根据
;根据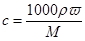 可知,硫酸铜溶液的浓度是
可知,硫酸铜溶液的浓度是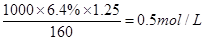 ,因此根据化学式可知SO42-的物质的量浓度为0.5mol/L。
,因此根据化学式可知SO42-的物质的量浓度为0.5mol/L。
(2)由于在稀释过程中溶质的物质的量是不变的,所以稀释后硫酸铜的浓度是0.5mol/L÷5=0.1mol/L。
(3稀释后的溶质中硫酸铜的物质的量是0.1L×0.1mol/L=0.01mol,而氢氧化钠的物质的量是0.1mol,所以根据反应反应的方程式2NaOH+CuSO4=Na2SO4+Cu(OH)2↓可知,氢氧化钠是过量的,所以生成氢氧化铜的物质的量是0.01mol,质量是0.01mol×98g/mol=0.98g。反应后溶液中的溶质是氢氧化钠和硫酸钠。
(1)溶液的质量是200ml×1.25g/ml=250g,溶质硫酸铜的质量是
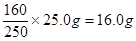 ,所以溶液中硫酸铜的质量分数是
,所以溶液中硫酸铜的质量分数是 ;根据
;根据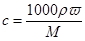 可知,硫酸铜溶液的浓度是
可知,硫酸铜溶液的浓度是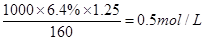 ,因此根据化学式可知SO42-的物质的量浓度为0.5mol/L。
,因此根据化学式可知SO42-的物质的量浓度为0.5mol/L。(2)由于在稀释过程中溶质的物质的量是不变的,所以稀释后硫酸铜的浓度是0.5mol/L÷5=0.1mol/L。
(3稀释后的溶质中硫酸铜的物质的量是0.1L×0.1mol/L=0.01mol,而氢氧化钠的物质的量是0.1mol,所以根据反应反应的方程式2NaOH+CuSO4=Na2SO4+Cu(OH)2↓可知,氢氧化钠是过量的,所以生成氢氧化铜的物质的量是0.01mol,质量是0.01mol×98g/mol=0.98g。反应后溶液中的溶质是氢氧化钠和硫酸钠。

练习册系列答案
相关题目