题目内容
已知MnO2与浓盐酸可以发生如下反应:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求:
(1)反应过程中转移电子的物质的量为多少?
(2)参加反应的MnO2质量是多少?
| ||
(1)反应过程中转移电子的物质的量为多少?
(2)参加反应的MnO2质量是多少?
(1)氧化还原反应4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O中,失电子的元素氯元素,化合价升高,得电子的元素锰元素,化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=2mol,
故答案为:反应过程中转移电子的物质的量为2mol;
(2)标准状况下2.24L氯气的物质的量n=
=
=0.1mol,因为消耗二氧化锰的量和产生氯气的量之间的关系为:MnO2~Cl2↑,所以参加反应的MnO2的物质的量为0.1mol,质量m=nM=0.1mol×87g/mol=8.7g,
故答案为:参加反应的MnO2质量是8.7g.
| ||
故答案为:反应过程中转移电子的物质的量为2mol;
(2)标准状况下2.24L氯气的物质的量n=
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
故答案为:参加反应的MnO2质量是8.7g.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
 MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求:
MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求: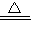 MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求:
MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求: