题目内容
(8分)一定质量由铝粉和四氧化三铁组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细并分成两等份,分别投入过量的烧碱溶液和盐酸中,充分反应后,前者消耗m mol NaOH,放出0.336 L气体;后者消耗n mol HCl,放出V L气体。若将等质量的这种铝热剂中铝粉与足量的稀硫酸反应,可得到3.36 L气体(气体体积均在标准状况下测定)。求:
(1)该铝热剂组成成分的质量分数。
(2)m、n、V的值。
(1)该铝热剂组成成分的质量分数。
(2)m、n、V的值。
(1)φ(Al)="27.95% " φ(Fe3O4)=72.05%
(2)m="0.05" mol n="0.24" mol
V="1.344" L
(2)m="0.05" mol n="0.24" mol
V="1.344" L
根据题意,进行铝热反应后的混合物投入烧碱溶液中,产生气体,说明铝粉过量,Fe3O4完全反应。由于等质量的铝和酸、碱反应,放出H2的量相等,由2Al~3H2可知:
原铝热剂中铝的总质量m1(Al)= ×27 g·mol-1="2.7" g
×27 g·mol-1="2.7" g
发生铝热反应后剩余铝的质量m2(Al)= ×2×27 g·mol-1="0.54" g
×2×27 g·mol-1="0.54" g
铝热反应消耗铝的质量m3(Al)="2.7" g-0.54 g="2.16" g
(1)由8Al+3Fe3O4 9Fe+4Al2O3,则
9Fe+4Al2O3,则
m(Fe3O4)= ="6.96" g
="6.96" g
m(Fe)=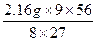 ="5.04" g
="5.04" g
m(Al2O3)=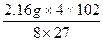 ="4.08" g
="4.08" g
故φ(Al)=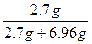 ×100%=27.95%
×100%=27.95%
φ(Fe3O4)=1-27.95%=72.05%
(2)根据原子守恒Al~NaAlO2~NaOH
m="n(NaOH)="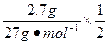 ="0.05" mol
="0.05" mol
由2Al~6HCl~3H2 Al2O3~6HCl Fe~2HCl~H2
n=n(HCl)=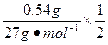 ×3+
×3+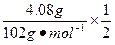 ×6+
×6+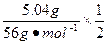 ×2="0.24" mol
×2="0.24" mol
V=V(H2)="("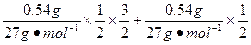 )×22.4 L·mol-1="1.344" L
)×22.4 L·mol-1="1.344" L
原铝热剂中铝的总质量m1(Al)=
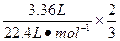 ×27 g·mol-1="2.7" g
×27 g·mol-1="2.7" g发生铝热反应后剩余铝的质量m2(Al)=
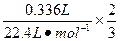 ×2×27 g·mol-1="0.54" g
×2×27 g·mol-1="0.54" g铝热反应消耗铝的质量m3(Al)="2.7" g-0.54 g="2.16" g
(1)由8Al+3Fe3O4
 9Fe+4Al2O3,则
9Fe+4Al2O3,则m(Fe3O4)=
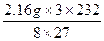 ="6.96" g
="6.96" gm(Fe)=
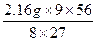 ="5.04" g
="5.04" gm(Al2O3)=
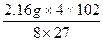 ="4.08" g
="4.08" g故φ(Al)=
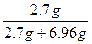 ×100%=27.95%
×100%=27.95%φ(Fe3O4)=1-27.95%=72.05%
(2)根据原子守恒Al~NaAlO2~NaOH
m="n(NaOH)="
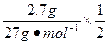 ="0.05" mol
="0.05" mol由2Al~6HCl~3H2 Al2O3~6HCl Fe~2HCl~H2
n=n(HCl)=
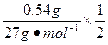 ×3+
×3+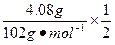 ×6+
×6+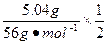 ×2="0.24" mol
×2="0.24" molV=V(H2)="("
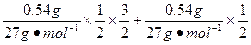 )×22.4 L·mol-1="1.344" L
)×22.4 L·mol-1="1.344" L
练习册系列答案
相关题目