题目内容
设NA表示阿伏加德常数的数值,下列叙述中不正确的是( )A.常温常压下,20gD2O和足量的金属钠反应产生气体的分子数为0.5NA
B.常温常压下,32gO-2离子中所含电子的数目为17NA
C.含0.01molH2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.02NA
D.53gNa2CO3固体含有的离子数为1.5NA
【答案】分析:A、根据n=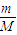 计算水的物质的量,根据方程式计算生成的气体,再根据N=nNA计算分子数目.
计算水的物质的量,根据方程式计算生成的气体,再根据N=nNA计算分子数目.
B、根据n=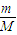 计算32gO-2离子的物质的量,每个O-2离子含有17个电子,根据N=nNA计算电子数目.
计算32gO-2离子的物质的量,每个O-2离子含有17个电子,根据N=nNA计算电子数目.
C、H2O2分解反应中,H2O2起还原剂与氧化剂作用,各占 ,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,据此计算.
,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,据此计算.
D、根据n=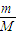 计算碳酸钠的物质的量,每摩尔碳酸钠含有3mol离子,根据N=nNA计算离子数目.
计算碳酸钠的物质的量,每摩尔碳酸钠含有3mol离子,根据N=nNA计算离子数目.
解答:解:A、20gD2O的物质的量为1mol,钠与水反应2Na+2D2O=2NaOD+D2↑,由方程式可知,1mol水反应生成D20.5mol,D2的分子数为0.5mol×NAmol-1=0.5NA;故A正确;
B、32gO-2离子的物质的量为1mol,每个O-2离子含有17个电子,含有电子数为1mol×17×NAmol-1=17NA;故B正确;
C、H2O2分解2H2O2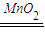 2H2O+O2↑,H2O2起还原剂与氧化剂作用,各占
2H2O+O2↑,H2O2起还原剂与氧化剂作用,各占 ,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,0.01mol×
,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,0.01mol× ×2×NAmol-1=0.01NA,故C错误;
×2×NAmol-1=0.01NA,故C错误;
D、53gNa2CO3固体的物质的量为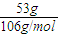 =0.5mol,每摩尔碳酸钠含有3mol离子,所以含有离子数为0.5mol×3×NAmol-1=1.5NA,故D正确.
=0.5mol,每摩尔碳酸钠含有3mol离子,所以含有离子数为0.5mol×3×NAmol-1=1.5NA,故D正确.
故选:C.
点评:考查常用化学计量的有关计算,难度中等,注意公式的灵活运用与氧化还原反应中电子转移计算.
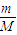 计算水的物质的量,根据方程式计算生成的气体,再根据N=nNA计算分子数目.
计算水的物质的量,根据方程式计算生成的气体,再根据N=nNA计算分子数目.B、根据n=
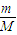 计算32gO-2离子的物质的量,每个O-2离子含有17个电子,根据N=nNA计算电子数目.
计算32gO-2离子的物质的量,每个O-2离子含有17个电子,根据N=nNA计算电子数目.C、H2O2分解反应中,H2O2起还原剂与氧化剂作用,各占
 ,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,据此计算.
,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,据此计算.D、根据n=
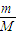 计算碳酸钠的物质的量,每摩尔碳酸钠含有3mol离子,根据N=nNA计算离子数目.
计算碳酸钠的物质的量,每摩尔碳酸钠含有3mol离子,根据N=nNA计算离子数目.解答:解:A、20gD2O的物质的量为1mol,钠与水反应2Na+2D2O=2NaOD+D2↑,由方程式可知,1mol水反应生成D20.5mol,D2的分子数为0.5mol×NAmol-1=0.5NA;故A正确;
B、32gO-2离子的物质的量为1mol,每个O-2离子含有17个电子,含有电子数为1mol×17×NAmol-1=17NA;故B正确;
C、H2O2分解2H2O2
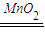 2H2O+O2↑,H2O2起还原剂与氧化剂作用,各占
2H2O+O2↑,H2O2起还原剂与氧化剂作用,各占 ,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,0.01mol×
,起还原剂作用的H2O2中氧元素化合价由-1价升高为0价,0.01mol× ×2×NAmol-1=0.01NA,故C错误;
×2×NAmol-1=0.01NA,故C错误;D、53gNa2CO3固体的物质的量为
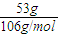 =0.5mol,每摩尔碳酸钠含有3mol离子,所以含有离子数为0.5mol×3×NAmol-1=1.5NA,故D正确.
=0.5mol,每摩尔碳酸钠含有3mol离子,所以含有离子数为0.5mol×3×NAmol-1=1.5NA,故D正确.故选:C.
点评:考查常用化学计量的有关计算,难度中等,注意公式的灵活运用与氧化还原反应中电子转移计算.

练习册系列答案
相关题目