题目内容
有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1。要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2 mol·L-1的NaOH溶液的体积为( )
A.80 mL B.100 mL C.120 mL D.140 mL
A
【解析】
试题分析:Mg(OH)2与Al(OH)3都是难溶性沉淀,二者沉淀时无法分先后,可认为同时沉淀,但当其都沉淀时,想只得到Mg(OH)2沉淀并与Al3+恰好分开,需让生成的氢氧化铝再与NaOH反应,发生反应Al(OH)3+OH-====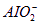 +2H2O,故二者所需NaOH可分成两大部分:Mg2+沉淀需NaOH为:0.2 mol·L-1×0.1 L×2="0.04" mol;沉淀Al3+并使之转化为
+2H2O,故二者所需NaOH可分成两大部分:Mg2+沉淀需NaOH为:0.2 mol·L-1×0.1 L×2="0.04" mol;沉淀Al3+并使之转化为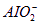 所需NaOH,先利用Cl-守恒求出c(Al3+)="(1.3"
mol·L-1×0.1 L-0.2 mol·L-1×0.1 L×2)÷3÷0.1 L="0.3" mol·L-1,则所需NaOH的物质的量为0.3 mol·L-1×0.1
L×4="0.12" mol,总的NaOH为0.12 mol+0.04
mol="0.16" mol,则至少需2 mol·L-1的NaOH溶液的体积为:
所需NaOH,先利用Cl-守恒求出c(Al3+)="(1.3"
mol·L-1×0.1 L-0.2 mol·L-1×0.1 L×2)÷3÷0.1 L="0.3" mol·L-1,则所需NaOH的物质的量为0.3 mol·L-1×0.1
L×4="0.12" mol,总的NaOH为0.12 mol+0.04
mol="0.16" mol,则至少需2 mol·L-1的NaOH溶液的体积为: 。
。
考点:混合物中物质含量的计算;Mg2+、Al3+ 的性质
点评:本题主要考查Mg2+、Al3+ 的性质以及Al(OH)3 沉淀的变化,同时要求会化学计算,综合能力较强,题目难度中等。

 阅读快车系列答案
阅读快车系列答案有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1。要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2 mol·L-1的NaOH溶液的体积为( )
| A.80 mL | B.100 mL | C.120 mL | D.140 mL |