题目内容
现有下列九种物质:①H2 ②铝 ③CuO ④CO2 ⑤稀H2SO4 ⑥稀硝酸 ⑦氨水 ⑧Ba(OH)2固体 ⑨熔融Al2(SO4)3 ,用序号回答下列问题。
(1)上述物质中,属于碱的是 。
(2)上述物质或溶液中若两两反应的离子方程式为:H++OH— H2O,则对应的两种物质是 。
H2O,则对应的两种物质是 。
(3)上述物质或其溶液若两两反应生成氢气,则对应的两种物质的组合分别是 。
(4)17.1g⑨溶于水配成250mL溶液, SO42-的物质的量浓度为 。
(5)在⑧的溶液中通入过量的④,写出总反应的离子方程式 。
(6)在特殊条件下,②与⑥发生反应的化学方程式为:8Al + 30HNO3 = 8Al(NO3)3 +3X + 9H2O,该反应中X的化学式是 ,其中还原剂与氧化剂的物质的量之比是 ,当有8.1g Al发生反应时,转移电子的物质的量为 。
(1)⑧ (2)⑥和⑧ (3)②和⑤;②和⑧ (各1分) (4)0.6 mol·L-1。
(5)OH—+CO2=HCO3—。(6)NH4NO3,8:3,0.9mol。
【解析】
试题分析:(1)氨水显碱性,但氨水不属于碱,它是混合物;(2)离子方程式为:H++OH—=H2O,表明是强酸与强碱反应生成可溶性盐的中和反应;(3)反应生成氢气,则必须有铝参与反应,另外一种物质可以是酸(硝酸除外),也可以是强碱;(4)根据c=n/v ,可得SO42-的物质的量浓度为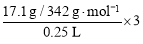 =0.6 mol/L ;(5)向Ba(OH)2的溶液中通入过量的CO2 ,先生成沉淀,后沉淀又溶解,最终生成酸式盐,总反应的离子方程式OH—+CO2=HCO3—;(6)根据H原子守恒,X中含有H元素,可知X为铵盐,X为NH4NO3 ,再由电子守恒验证即可,还原剂是铝,氧化剂是硝酸,根据N原子的变价个数可知,有3个硝酸得电子,还原剂与氧化剂的物质的量之比是 8 : 3,当8.1g Al发生反应时,铝失去电子的物质的量为
=0.6 mol/L ;(5)向Ba(OH)2的溶液中通入过量的CO2 ,先生成沉淀,后沉淀又溶解,最终生成酸式盐,总反应的离子方程式OH—+CO2=HCO3—;(6)根据H原子守恒,X中含有H元素,可知X为铵盐,X为NH4NO3 ,再由电子守恒验证即可,还原剂是铝,氧化剂是硝酸,根据N原子的变价个数可知,有3个硝酸得电子,还原剂与氧化剂的物质的量之比是 8 : 3,当8.1g Al发生反应时,铝失去电子的物质的量为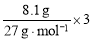 =0.9 mol。
=0.9 mol。
考点:本题考查碱的概念、中和反应的实质、离子方程式的书写及有关氧化还原反应的计算。