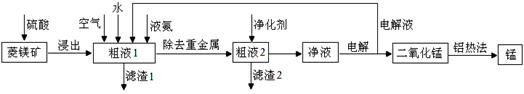
题目内容
(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假设该粗盐水中
,假设该粗盐水中 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式__ ___。
(16分)
(1)SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
(2)a(2分);碳酸钙(或CaCO3)(2分)
(3)a(2分);SiCl4+2H2 Si+4HCl(2分)
Si+4HCl(2分)
(4)氢气(或H2)(2分);NaOH(2分);NaCl+H2O  NaClO+H2↑(2分)
NaClO+H2↑(2分)
解析试题分析:(1)C在高温条件下还原SiO2,生成Si和CO,化学方程式为:SiO2+2C Si+2CO↑
Si+2CO↑
(2)Na2CO3溶液的作用为除去Ca2+、除去过量的BaCl2溶液,所以Na2CO3的顺序在BaCl2的后面,HCl的作用是除去过量的Na2CO3和NaOH,所以在最后,因此a项正确;因为Ksp(MgCO3) < Ksp(CaCO3),CaCO3更难溶,所以首先析出的沉淀是CaCO3。
(3)SiCl4与CCl4在常温下为液体,相互溶解,但沸点不同,所以用蒸馏的方法得到纯净的SiCl4;反应器II中H2还原SiCl4,化学方程式为:SiCl4+2H2 Si+4HCl。
Si+4HCl。
(4)根据放电顺序,阴极上H2O电离出的H+放电,所以电解槽中阴极产生的气体是氢气;水电离出的H+放电,促进H2O的电离平衡向右移动,OH?浓度增大,所以产品A为NaOH;无膜电解槽电解饱和食盐水可制取次氯酸钠,电解产生的Cl2与NaOH反应生成次氯酸钠,所以化学方程式为:NaCl+H2O  NaClO+H2↑
NaClO+H2↑
考点:本题考查化学方程式的书写、除杂、电解的应用。

某化学兴趣小组拟采用下图所示装置电解饱和氯化钠溶液制备H2,通过H2还原氧化铜测定Cu的相对原子质量Ar(Cu),同时检验Cl2的氧化性(图中夹持和加热仪器已略去)。
(1)直流电源中的X极为 极(填“正”、“负”、“阴”或“阳”);写出甲装置U形管中反应的离子方程式: ;实验开始后,用铁棒作电极的一侧的实验现象是 。
(2)为完成上述实验,正确的链接顺序为:a连 ,b连 (填写连接的字母)。
(3)装置乙中的G瓶内溶液可能为 (填字母)。
| A.淀粉KI溶液 | B.NaOH溶液 | C.Na2S溶液 | D.Na2SO3溶液 |
(4)在对硬质玻璃试管里的氧化铜粉末加热前需要进行的操作为: 。
(5)装置丙中N瓶内盛放的试剂为 ,作用是 。
(6)为了测定Cu的相对原子质量,某同学通过实验测得如一下数据:
I.氧化铜样品质量为m1g
Ⅱ.反应后硬质玻璃管中剩余固体质量为m2g
Ⅲ.反应前后U形管及其固体质量差为m3g
Ⅳ.反应前后瓶及其液体质量差为m4g
①请选择理论上误差最小的一组数据计算Ar(Cu),Ar(Cu)= 。
②如果选用其它数据进行计算,会导致Ar(Cu) (填“偏大”、“偏小”或“无影响”),理由是 。
下列有关同分异构体数目的叙述中,不正确的是( )
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B.分子式符合C5H11Cl的化合物有6种 |
| C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D.菲的结构简式为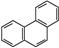 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
下表中实验操作能达到实验目的的是
| | 实验操作 | 实验目的 |
| A | 向苯酚的饱和溶液中滴加稀溴水 | 验证三溴苯酚为白色沉淀 |
| B | 向甲酸钠溶液中加新制的Cu(OH)2悬浊液并加热 | 确定甲酸钠中含有醛基 |
| C | 向酒精和乙酸的混合液中加入金属钠 | 确定酒精中混有醋酸 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
| 1 | 2 | 3 | 4 | 5 | …… |
| CH4 | C2H6 | C5H12 | C8H18 | …… | …… |

 。
。