题目内容
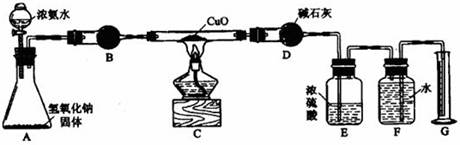
(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。

⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是 。
⑸E装置中盛装浓硫酸的目的是 。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示)
【答案】
⑴2NH3+3CuO N2+3Cu+3H2O
(2分)
N2+3Cu+3H2O
(2分)
⑵NaOH固体吸水及溶解产生的热利于氨气的逸出。 (2分)
⑶C (2分)
⑷黑色粉末变为光亮的红色固体。 (2分)
⑸将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差。 (2分)
⑹3a/22.4(2分) 9a/11.2b(2分)
【解析】略

练习册系列答案
相关题目
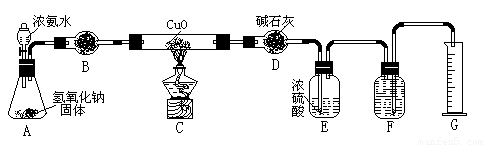
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: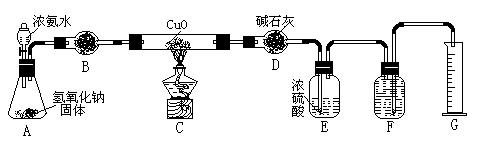
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
(
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
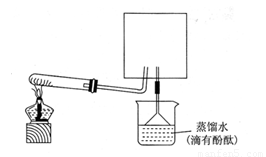
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
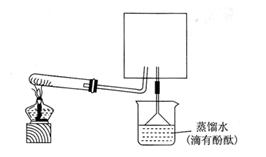
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
 。
。