题目内容
现有等物质的量的Mg和Al的混合物a g与100 ml盐酸反应,(气体体积均以标准状况计算)
(1)、该混合物中Mg和Al的质量比为
(2)、如果金属与盐酸恰好完全反应,则盐酸的浓度为
(3)、如果反应后金属有剩余,盐酸不足,要计算生成H2的体积,还需要知道
(1)、质量比为 8:9 (2)、盐酸的浓度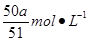
(3)、还需要知道盐酸的浓度或者盐酸的体积
(4)、H2的体积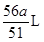
(5)、范围 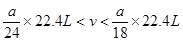
解析试题分析:
(1)设Mg是XgAl是Yg;则有X\24=Y/27,可知X:Y=8:9
(2)根据电荷守恒可得:Mg→Mg2+,Al→Al3+ ,则有:[(8/17/24)2+(9/17/27)3]a/0.1=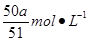
(3)H2中的氢全部来自于盐酸,所以只需知道盐酸的物质的量,就可知道生成的氢气的体积,题干中已知盐酸体积,所以只需知道盐酸的浓度即可。
考点:金属混合物与酸反应的定量计算。
点评:本题涉及到了混合物与酸反应的定量计算,计算难度提升,学生在解题时不但利用方程式解析,还需要利用元素守恒,电荷守恒等。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目