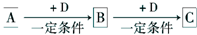题目内容
有如下三个热化学方程式:
H2(g)+
O2(g)═H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=b kJ?mol-1
2H2O(l)═2H2(g)+O2(g)△H=c kJ?mol-1
关于它们的下列表述,正确的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2O(l)═2H2(g)+O2(g)△H=c kJ?mol-1
关于它们的下列表述,正确的是( )
分析:燃烧反应均为放热反应,则△H<0,物质的聚集状态不同,反应放出的热量不同,热化学反应方程式中物质的量的化学计量数与反应放出的热量成正比,以此来解答.
解答:解:A.因燃烧反应为放热反应,则氢气燃烧是放热反应,故A错误;
B.放热反应的△H<0,则a、b和c均为负值,故B正确;
C.因水的状态不同,则a≠b,故C错误;
D.热化学反应方程式中物质的量与反应放出的热量成正比,则反应热的关系为2b=c,故D错误;
故选:B.
B.放热反应的△H<0,则a、b和c均为负值,故B正确;
C.因水的状态不同,则a≠b,故C错误;
D.热化学反应方程式中物质的量与反应放出的热量成正比,则反应热的关系为2b=c,故D错误;
故选:B.
点评:本题考查燃烧反应的热化学反应方程式,注意物质的状态、化学计量数与反应热的关系即可解答,题目难度不大.

练习册系列答案
相关题目