题目内容
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
【答案】C
【解析】因为1mol硫酸镁变为氧化镁,质量减少80g。由图像可知,反应在2min达到平衡状态,固体的质量由240g变为144g,减少了96g,所以硫酸镁消耗了即减少了1.2mol,所以CO也要减少1.2mol、剩余0.8mol,CO2和SO2都生成了1.2mol。A. 0 ~2min内平均反应速率v(SO2)= ![]() 0.3mol·l-1 ·min-1,A正确;B. 2 ~4min内,反应处于化学平衡状态,容器内气体的密度没有变化,B正确;C. 该温度下,反应的平衡常数为
0.3mol·l-1 ·min-1,A正确;B. 2 ~4min内,反应处于化学平衡状态,容器内气体的密度没有变化,B正确;C. 该温度下,反应的平衡常数为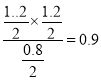 ,C不正确;D. 保持其他条件不变,起始时向1L容器中充入1.00 mol MgSO4和1.00 mol CO,反应达到平衡时与题中的平衡等效,可以求出n(CO2)= 0.6 mol。在此基础上,减小压强,把容器体积扩大到2L,则平衡向正反应方向移动,所以n(CO2)> 0.60 mol,D正确。本题选C。
,C不正确;D. 保持其他条件不变,起始时向1L容器中充入1.00 mol MgSO4和1.00 mol CO,反应达到平衡时与题中的平衡等效,可以求出n(CO2)= 0.6 mol。在此基础上,减小压强,把容器体积扩大到2L,则平衡向正反应方向移动,所以n(CO2)> 0.60 mol,D正确。本题选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目