题目内容
3.A、B、C、D、E属于短周期元素,且原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应.(1)写出:AODSi(元素符号),乙Na2O(化学式)
(2)E元素在周期表中的位置是第三周期,第VIA族.
(3)画出B的原子结构示意图
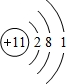 ;
;(4)D的氧化物与NaOH溶液反应的化学方程式SiO2+2NaOH=Na2SiO3+H2O;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示)2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 A、B、C、D、E属于短周期元素,且原子序数依次增大,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同,则A为O元素、B为Na,A 与E同主族,B、C、D、E同周期,则E为S元素,C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片,C、D的单质都能与强碱溶液反应,可推知C为Al、D为Si,据此解答.
解答 解:A、B、C、D、E属于短周期元素,且原子序数依次增大,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同,则A为O元素、B为Na,甲为Na2O2、乙为Na2O,A 与E同主族,B、C、D、E同周期,则E为S元素,C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片,C、D的单质都能与强碱溶液反应,可推知C为Al、D为Si.
(1)A为O元素,D为Si,乙为Na2O,故答案为:O;Si;Na2O;
(2)E为S元素,在周期表中的位置是第三周期,第VIA族,故答案为:三;VIA;
(3)B为Na元素,原子结构示意图为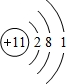 ,故答案为:
,故答案为: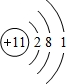 ;
;
(4)D的氧化物为SiO2,与NaOH溶液反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(5)Al单质在工业上的一种重要用途:焊接钢轨等,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,旨在考查学生对基础知识的巩固.

练习册系列答案
相关题目
14.茶叶中铁元素检验可用以下步骤完成,各步骤选用实验用品不能都用到的( )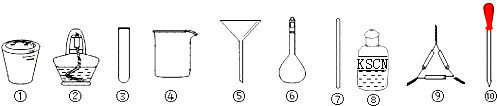

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 过滤得到滤液,选用④、⑤和⑦ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
11.治疗胃酸过多,但患有严重的胃溃疡,应该选择( )
| A. | 阿司匹林(乙酰水杨酸) | B. | 青霉素 | ||
| C. | 抗酸药(氢氧化铝) | D. | 麻黄碱 |
18.糖类是由C、H、O三种元素组成的一类有机化合物,糖类也叫碳水化合物,原因是它们的化学组成大多符合通式Cn(H2O)m.葡萄糖的分子式是C6H12O6,属于单糖(填“单糖”、“二糖”或“多糖”).
8.等物质的量的Na2CO3•mH2O和BaCl2•nH2O的混和物3.68克,加足量水搅拌,充分反应后可得到1.97克沉淀,则m和n的值分别为( )
| A. | 1和2 | B. | 1和3 | C. | 7和3 | D. | 10和2 |
15.某无色透明溶液能与铝反应产生氢气,则此溶液中可能大量共存的离子组是( )
| A. | K+、Mg2+、NO3-、Cl- | B. | K+、Na+、HCO3-、Cl- | ||
| C. | Cu2+、Na+、SO42-、Cl- | D. | Ba2+、Na+、NO3-、Cl- |
12.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 镁、干冰、硫酸、纯碱、食盐 | B. | 碘酒、冰、盐酸、烧碱、硫酸钡 | ||
| C. | 氢气、氧化钠、硝酸、烧碱、氯化铜 | D. | 铁、氧化铜、醋酸、石灰水、硝酸钾 |
13.下列离子方程式中正确的是( )
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42-+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
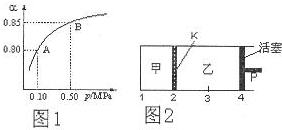 (3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
 (1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;