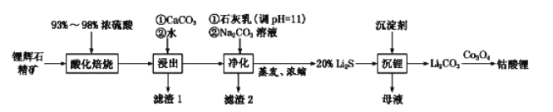
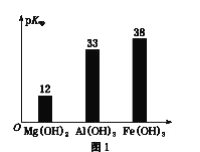
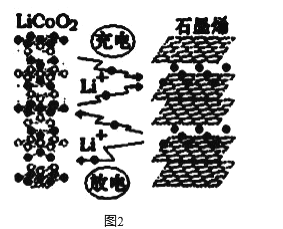
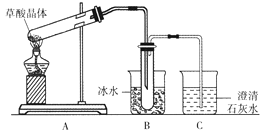
��Ŀ����
����Ŀ����������ΪӦ�����������ŷ������������������Դ�������⣬CO2�ۺ����ü�����ΪDZ�ڵĽ�������ܵ����о��ߵĹ㷺��ע���밴��Ҫ��ش�����
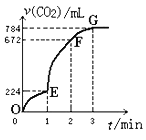
��1��CO�����ڹ�ҵұ����������ͼ���ڲ�ͬ�¶���CO��ԭ���ֽ����������ƽ���������![]() ���¶ȣ�t���Ĺ�ϵ����ͼ������˵����ȷ����________��������ţ�
���¶ȣ�t���Ĺ�ϵ����ͼ������˵����ȷ����________��������ţ�

A ��ҵ�Ͽ���ͨ�����߷�Ӧװ�����ӳ���ʯ��CO�Ӵ���ʱ�䣬����β����CO�ĺ���
B CO���������ڹ�ҵұ����������Cr��
C ��ҵұ������ͭ��Cu��ʱ�ϵ͵��¶����������CO��������
D CO��ԭPbO2�ķ�Ӧ��H>0
��2��һ��������Pd��Mg/SiO2������ʹCO2 �����黯�����Ϊ��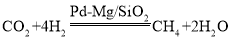 ����Ѵ��¶���200�桫300�����ң�����300���������ȫʧ���Ӧֹͣ�����ܱ�����ͨ��v��CO2����v��H2����1��4�ķ�Ӧ���壬���½��Ͽ�ʼ���ȣ��������ɼ���������¶ȵı仯����_________��
����Ѵ��¶���200�桫300�����ң�����300���������ȫʧ���Ӧֹͣ�����ܱ�����ͨ��v��CO2����v��H2����1��4�ķ�Ӧ���壬���½��Ͽ�ʼ���ȣ��������ɼ���������¶ȵı仯����_________��
��3�������˺�������Ӧ�õ绯ѧԭ������PtΪ������Pb��CO2�����壩Ϊ����KHCO3��ҺΪ�������Һ����ԭ������������CO2ͬʱ����O2���µ���ԴCO���������ĵ缫��ӦʽΪ___________��������H2CO3���볣��ԼΪK1��4��10��7��K2��5��10��11����0.025 mol��L��1��H2CO3��Һ��pHԼ����__________�������ǵڶ��������H2O�ĵ��룩
���𰸡�BC 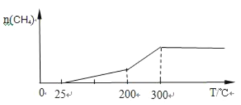 H2O��3CO2��2e��CO��2HCO3 4
H2O��3CO2��2e��CO��2HCO3 4
��������
(1)A������¯�ĸ߶ȣ�����CO������ʯ�ĽӴ�������Ӱ��ƽ���ƶ���
B����ͼ��֪��CO��ҵұ��������ʱ��lg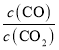 һֱ�ܸߣ�˵��COת���ʺܵͣ�
һֱ�ܸߣ�˵��COת���ʺܵͣ�
C����ͼ���֪�¶�Խ��lg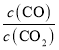 ԽС��
ԽС��
D����ͼ��֪CO��ԭPbO2���¶�Խ��lg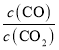 Խ�ߣ�˵��COת����Խ�ͣ�
Խ�ߣ�˵��COת����Խ�ͣ�
(2)��Ѵ��¶���200����300�����ң���Ӧ���ʴ����ɼ���࣬������300����������ȫʧ���Ӧֹͣ�����ɼ���������ֲ��䣻
(3)�����϶�����̼�õ���������CO��̼��������ӣ�������H2CO3���볣��ԼΪK1��4��107�������ǵڶ��������H2O�ĵ��룬��c(H��)��0.025��4��107mol/L��104mol/L��
(1)A������¯�ĸ߶ȣ�����CO������ʯ�ĽӴ�������Ӱ��ƽ���ƶ���CO�������ʲ��䣬���ܼ���β����CO��������A����
B����ͼ���֪��CO��ҵұ��������ʱ��lg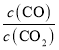 һֱ�ܸߣ�˵��COת���ʺܵͣ��ʲ��ʺϣ���B��ȷ��
һֱ�ܸߣ�˵��COת���ʺܵͣ��ʲ��ʺϣ���B��ȷ��
C����ͼ��֪�¶�Խ�ͣ�lg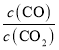 ԽС����COת����Խ�ߣ���C��ȷ��
ԽС����COת����Խ�ߣ���C��ȷ��
D����ͼ��֪CO��ԭPbO2���¶�Խ�ߣ�lg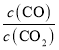 Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�������H��0����D����
Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�������H��0����D����
�ʴ�Ϊ��BC��
(2)���½��Ͽ�ʼ���ȣ������¶����ߣ���Ӧ���̼ӿ죬n(CH4)���ӣ��¶����ߵ�200��300������ʱ��n(CH4)���ӽϿ죬���¶ȳ���300��ʱ��������ȫʧ���Ӧֹͣ����n(CH4)���¶����߱��ֲ��䣬������Ϊʱ�䡢������Ϊ��������ʵ��������ɼ���������¶ȵı仯����Ϊ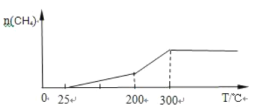 ���ʴ�Ϊ��
���ʴ�Ϊ��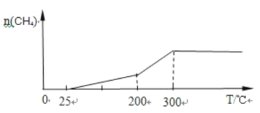 ��
��
(3)��PtΪ������Pb(CO2������)Ϊ������KHCO3��ҺΪ�������Һ���ܷ�ӦΪ2CO2![]() 2CO��O2����������CO2�õ����ӷ�����ԭ��Ӧ����CO���ɵ����غ㡢����غ㡢ԭ���غ��֪������ӦʽΪH2O��3CO2��2e��CO��2HCO3�������� H2CO3���볣��ԼΪK1��4��107�������ǵڶ��������H2O�ĵ��룬��c(H��)��0.025��4��107mol/L��104mol/L��pH��lg104��4���ʴ�Ϊ��H2O��3CO2��2e��CO��2HCO3��4��
2CO��O2����������CO2�õ����ӷ�����ԭ��Ӧ����CO���ɵ����غ㡢����غ㡢ԭ���غ��֪������ӦʽΪH2O��3CO2��2e��CO��2HCO3�������� H2CO3���볣��ԼΪK1��4��107�������ǵڶ��������H2O�ĵ��룬��c(H��)��0.025��4��107mol/L��104mol/L��pH��lg104��4���ʴ�Ϊ��H2O��3CO2��2e��CO��2HCO3��4��

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�