题目内容
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 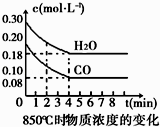
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
【答案】
(1)0.03
(2)![]()
(3)60%
(4)BC;增大;减小
(5)大于;D;A
【解析】解:(1)由图可知,CO起始浓度为0.2mol/L、H2O的起始浓度为0.3mol/L,850℃时4min达到平衡,平衡时CO的浓度为0.08mol/L,则:
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
开始浓度(mol/L): | 0.2 | 0.3 | 0 | 0 | |
变化浓度(mol/L): | 0.12 | 0.12 | 0.12 | 0.12 | |
平衡浓度(mol/L): | 0.08 | 0.18 | 0.12 | 0.12 |
v(CO)= ![]() =0.03mol/(L.min),
=0.03mol/(L.min),
所以答案是:0.03;(2)CO(g)+H2O(g)CO2(g)+H2(g)
平衡常数K= ![]() ,
,
所以答案是: ![]() ;(3)依据(1)中的计算得到CO转化率=
;(3)依据(1)中的计算得到CO转化率= ![]() ×100%=60%;
×100%=60%;
所以答案是:60%;(4)CO(g)+H2O(g)CO2(g)+H2(g).所以是气体体积不变的放热反应,
A.反应前后气体系数和相等,容器中压强始终保持不变,不能说明反应达到了平衡,故A错误;
B.混合气体中c (CO)不变的状态是化学平衡状态的特征,故B正确;
C.速率之比等于化学方程式计量数之比为正反应速率之比,v(H2)正=v(H2O)逆说明水的正逆反应速率是相等的,反应达到了平衡状态,故C正确;
D.c(CO2)=c(CO)状态不是化学平衡状态的特征,故D错误;
故选BC;
起始浓度与(1)中相同,而(1)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,平衡常数只受温度的影响,反应是放热反应,若降低温度,平衡正向进行,该反应的K值将增大,反应的化学反应速率将减小,
所以答案是:BC;增大;减小;(5)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态;该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,即c1>0.08,
所以答案是:大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选D;
表中5min﹣6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选A,
所以答案是:D;A.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景.
(1)已知: CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式: .
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是 .
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | O﹣H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
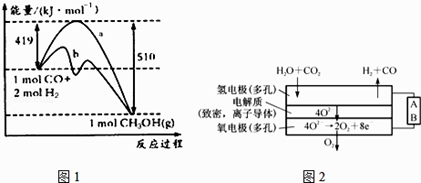
请回答下列问题:
①如图中曲线a到曲线b的措施是 .
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电. ①该电池正极的电极反应式为 .
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为 .
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700﹣1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2﹣ , O2﹣穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2 . 由右图可知A为直流电源的(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式: .