题目内容
(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
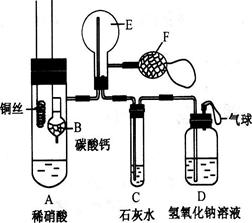
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作 。
如何确定E中空气已被赶尽:__________________________________ 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作 。
如何确定E中空气已被赶尽:__________________________________ 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________
(12分)(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2(2分);
当C处出现白色沉淀时(2分)
(2)3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O(2分)
(3)用F向E中鼓入空气,E内颜色加深(2分);
3NO2+H2O=2HNO3+NO(2分);CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑(2分)
当C处出现白色沉淀时(2分)
(2)3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O(2分)
(3)用F向E中鼓入空气,E内颜色加深(2分);
3NO2+H2O=2HNO3+NO(2分);CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑(2分)
(1)要排尽装置中的空气,可以利用碳酸钙和酸反应产生的CO2来实现。所以操作是将装CaCO3的干燥管下移与稀HNO3反应产生CO2。因为CO2和石灰水反应能产生白色沉淀,所以当C处出现白色沉淀时,空气就已经被排尽。
(2)稀硝酸和铜生成NO、硝酸铜和水,方程式为3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O。
(3)由于NO极易被氧气氧化,生成红棕色的NO2,据此可以判断。操作是用F向E中鼓入空气,E内颜色加深,即证明是NO,而不是氢气。由于NO2溶于水生成硝酸,硝酸能溶解碳酸钙,方程式为3NO2+H2O=2HNO3+NO(2分)、CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑。
(2)稀硝酸和铜生成NO、硝酸铜和水,方程式为3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O。
(3)由于NO极易被氧气氧化,生成红棕色的NO2,据此可以判断。操作是用F向E中鼓入空气,E内颜色加深,即证明是NO,而不是氢气。由于NO2溶于水生成硝酸,硝酸能溶解碳酸钙,方程式为3NO2+H2O=2HNO3+NO(2分)、CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目