题目内容
4.由二氧化氮、氨、氧气组成的混合气体,在标准状况下占有的体积是22.4L.通过量酸充分吸收后,溶液质量增加了35.8g,气体体积缩小至2.24L(已折算成标准状况).试通过计算求出原混合气体中各气体的体积.分析 根据n=$\frac{V}{{V}_{m}}$计算出原混合气体及最后剩余气体的物质的量;剩余的气体可能为氧气,也可能为NO;当剩余气体为NO时,氧气完全反应,设氨气的物质的量是xmol,氧气是ymol,二氧化氮的物质的量为4y+0.3;当剩余气体为氧气时,二氧化氮完全反应,设原混合气体中氨气、二氧化氮的物质的量分别为x、y,则氧气的总物质的量为:$\frac{1}{4}$y+0.1;再分别根据混合气体总物质的量、稀硫酸溶液增加质量列式计算即可.
解答 解:标准状况下22.4L气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,
最后得到的2.24L气体的物质的量为0.1mol,0.1mol气体可能为氧气,也可能为NO,
当剩余0.1mol气体为NO时,氧气和NO2溶于水的方程式为4NO2+O2+2H2O=4HNO3,过量的NO2发生反应3NO2+H2O=2HNO3+NO,所以过量的NO2是0.3mol;稀硫酸增加的质量包括氨气和参加反应的NO2和氧气的质量之和,原气体总共1mol,若设氨气的物质的量是xmol,氧气是ymol,
则:x+y+4y+0.3=1、17x+4y×46+32y+0.3×46-0.1×30=35.8g,
解得:x=0.2、y=0.1,所以NO2的物质的量是:4y+0.3mol=0.7mol;
所以原混合气体最后氨气的体积为:22.4L/mol×0.2mol=4.48L;二氧化氮体积为:22.4L/mol×0.7mol=15.68L;氧气体积为:22.4L/mol×0.1mol=2.24L;
当剩余的0.1mol气体为氧气时,二氧化氮完全反应生成硝酸,氧气和NO2溶于水的方程式为:4NO2+O2+2H2O=4HNO3,设原混合气体中氨气、二氧化氮的物质的量分别为x、y,则氧气的总物质的量为:$\frac{1}{4}$y+0.1,则:x+y+$\frac{1}{4}$y+0.1=1、17x+46y+$\frac{1}{4}$y×32=35.8,
解得:x=0.11mol、y=0.63mol,则氧气的总物质的量为:$\frac{1}{4}$y+0.1mol=0.26mol,
所以原混合气体最后氨气的体积为:22.4L/mol×0.11mol=2.464;二氧化氮体积为:22.4L/mol×0.63mol=14.112L;氧气体积为:22.4L/mol×0.26mol=5.824L;答:原混合气体中氨气、二氧化氮、氧气的体积分别为:4.48L、15.68L、2.24L或2.464L、14.112L、5.824L.
点评 本题考查了混合物反应的计算,题目难度中等,明确最后剩余气体组成及发生反应实质为解答关键,注意掌握讨论法在化学计算最后的应用,试题充分考查了学生的分析、理解能力及化学计算能力.

| A. | SO2能使高锰酸钾溶液褪色 | |
| B. | S在O2中燃烧生成SO3 | |
| C. | 二氧化硫的漂白原理与次氯酸相同 | |
| D. | SO2通入BaC12溶液中能产生白色沉淀 |
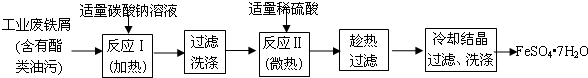
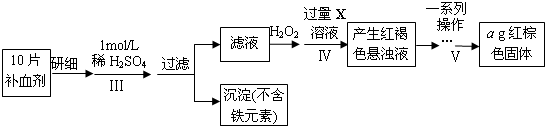
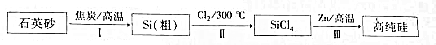
 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.