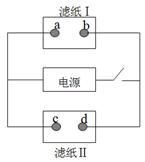
题目内容
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
D
试题分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电。
Cu(OH)2从组成上可看成CuO?H2O,溶液中加入0.1 mol Cu(OH)2后,溶液恰好恢复到电解前的浓度和pH,这说明电解生成了0.1 mol 氧化铜,并消耗0.1 mol H2O。由电解的总反应式可知:
2H2O+2CuSO4
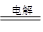 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子2mol 4mol
0.1mol 0.2mol
2H2O
 2H2↑+O2↑ 转移电子
2H2↑+O2↑ 转移电子2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.2mol+0.2mol=0.4 mol,答案选D。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题综合性强,贴近高考,有利于激发学生的学习兴趣和学习积极性。明确电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量。该题的关键是准确判断出电解分为2个阶段。

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目