题目内容
下列各组元素性质的递变情况错误的是( )
| A、N、O、F原子半径依次减小 |
| B、P、S、Cl元素最高正价依次升高 |
| C、Li、Be、B原子最外层电子数依次增多 |
| D、Na、K、Rb的电子层逐渐减少 |
考点:微粒半径大小的比较,同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:A.同周期元素从左到右原子半径逐渐减小;
B.根据原子核外最外层电子数判断;
C.根据原子核外电子排布分析;
D.同主族元素从上到下电子层数逐渐增多.
B.根据原子核外最外层电子数判断;
C.根据原子核外电子排布分析;
D.同主族元素从上到下电子层数逐渐增多.
解答:
解:A.N、O、F均在第二周期,原子序数逐渐增大,则从左向右原子半径逐渐减小,故A正确;
B.P、S、Cl元素最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7,最高正价依次升高,故B正确;
C.Li、Be、B原子最外层电子数分别为1、2、3,则原子最外层电子数依次增多,故C正确;
D.Na、K、Rb在同一主族,从上到下元素的电子层逐渐增大,故D错误.
故选D.
B.P、S、Cl元素最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7,最高正价依次升高,故B正确;
C.Li、Be、B原子最外层电子数分别为1、2、3,则原子最外层电子数依次增多,故C正确;
D.Na、K、Rb在同一主族,从上到下元素的电子层逐渐增大,故D错误.
故选D.
点评:本题考查元素周期律的递变规律,为高频考点,题目难度不大,注意把握元素周期律的递变规律与元素在周期表中的位置关系.

练习册系列答案
相关题目
元素周期表中铋元素的数据见图,下列说法不正确的是( )


| A、Bi原子s轨道的形状是球形的,p轨道的形状是纺锤形 |
| B、Bi元素的相对原子质量是209.0 |
| C、Bi原子6p能级中6px、6py、6pz轨道上各有一个电子 |
| D、Bi原子最外层有5个能量相同的电子 |
下列物质属于同分异构体的一组是( )
| A、淀粉和纤维素 |
B、CH3-CH2-CH2-CH3 与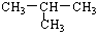 |
| C、1H 和2H |
| D、O2与O3 |
组成为C7H8的芳香烃完全加氢后,其生成物的一氯代物有( )种.
| A、3种 | B、4种 | C、5种 | D、6种 |
能大量共存于同一溶液中,在该溶液中加入过量的NaOH溶液或适量稀硫酸,都可能产生白色沉淀的离子组是( )
| A、NH4+ Ba2+ Fe3+ Cl- |
| B、Ba2+ Mg2+ NO3- Ca2+ |
| C、H+ Ba2+ Al3+ Cl- |
| D、K+ Ca2+ OH- HCO3- |
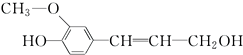 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )| A、该物质的分子式是C10H12O3,不属于芳香烃 |
| B、每摩尔该物质最多能消耗4mol H2 |
| C、遇FeCl3溶液呈血红色 |
| D、该物质能发生酯化反应 |
下列气体在氧气中充分燃烧后,其产物既可使无水硫酸铜变蓝色,又可使澄清石灰水变浑浊的是( )
| A、CO2 |
| B、CH4 |
| C、H2 |
| D、CO |
下列叙述中正确的是( )
| A、红宝石、珍珠、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| B、光导纤维导电能力很强,是一种良好的通信材料 |
| C、硅胶多孔,吸水能力强,所以常用作袋装食品的干燥剂 |
| D、硅的化学性质不活泼,在自然界中主要以游离态存在 |