题目内容
(2011?姜堰市二模)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.
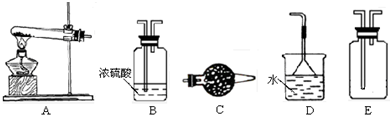
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级

(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的
ACDE
ACDE
.(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
NH3
NH3
,写出制纳米级碳酸钙的化学方程式:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
.(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是
取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是
.分析:(1)根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置.
(2)根据二氧化碳和氨气的溶解性判断先通入的气体,由反应物和生成物写出反应方程式.
(3)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以根据胶体的性质确定实验方案.
(2)根据二氧化碳和氨气的溶解性判断先通入的气体,由反应物和生成物写出反应方程式.
(3)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以根据胶体的性质确定实验方案.
解答:解:(1)实验室制取氨气采用固体、固体加热型装置,所以应选A为反应装置;生成物中含有水,氨气属于碱性气体,所以应选择碱性物质吸收水蒸气,故选C;氨气极易溶于水,且氨气的密度小于空气的密度,所以应采用向下排空气法收集,故选E;氨气有刺激性气味,所以不能直接排空;氨气极易溶于水,所以尾气处理应采用防止倒吸装置,用水吸收即可,故选D.
故答案为:ACDE.
(2)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O=
CaCO3↓+2NH4Cl.
故答案为NH3;CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(3)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以具有胶体的性质,运用胶体的丁达尔效应判断;取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
故答案为:ACDE.
(2)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O=
CaCO3↓+2NH4Cl.
故答案为NH3;CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(3)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以具有胶体的性质,运用胶体的丁达尔效应判断;取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
点评:本题考查了氨气的实验室制法,难度不大,注意根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目