题目内容
11.下列各组烃的混合物,只有总质量一定,无论按何比例混合,完全燃烧后生成CO2和H2O都是恒量的是( )| A. | C2H2、C2H4 | B. | C2H4、C3H6 | C. | C3H8、C3H6 | D. | C6H6、C7H8 |
分析 总质量固定,完全燃烧后生成CO2和H2O都是恒量,说明混合物中各物质分子中C、H元素的质量分数相同;若最简式相同,则完全燃烧生成二氧化碳和水的质量一定不变,结合烃的最简式来解答.
解答 解:A.最简式分别为CH、CH2,则总质量一定时,生成CO2和H2O不是恒量,故A不选;
B.最简式均CH2,C、H质量分数为定值,则总质量一定时,无论按何比例混合,完全燃烧后生成CO2和H2O是恒量,故B选;
C.C原子数相同,H原子数不同,最简式不同,则总质量一定时,生成CO2和H2O不是恒量,故C不选;
D.最简式不同,则总质量一定时,生成CO2和H2O不是恒量,故D不选;
故选B.
点评 本题考查混合物的计算,为高频考点,把握生成CO2和H2O都是恒量与C、H质量分数关系为解答的关键,侧重分析与计算能力的考查,注意最简式的判断及应用,题目难度不大.

练习册系列答案
相关题目
18.固体硝酸盐加热易分解且产物较复杂.某学习小组以AgNO3为研究对象,拟通过实验探究其热分解的产物,提出如下3种猜想:
甲:Ag2O、NO2、O2乙:Ag、NO2、O2 丙:Ag2O、NO2、N2
(1)实验前,小组成员经讨论认定猜想丙不成立,理由是不符合氧化还原反应原理.
查阅资料得知:
2NO2+2NaOH═NaNO3+NaNO2+H2O;Ag2O与粉末态的Ag均为黑色;Ag2O可溶于氨水.针对甲、乙猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,首先进行的操作是检验装置的气密性.
②将AgNO3固体置于A中,加热前通入N2以驱尽装置内的空气,其目的是避免对产物O2检验产生干扰;关闭K,用酒精灯加热时,正确操作是先移动酒精灯预热硬质玻璃管,然后固定在管中固体部位下加热.
③观察到A 中有红棕色气体出现,C、D 中有气泡.
④待样品完全分解,A 装置冷却至室温.
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论
①证明一定有O2生成的依据是C中的溶液不褪色,且D中的溶液褪色,与此相关的化学原理为Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4(用化学方程式表示).
②针对试管中残留黑色固体的成分,该学习小组进行了如下探究:
【提出假设】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?有,应在AB装置间增加防倒吸的装置.
甲:Ag2O、NO2、O2乙:Ag、NO2、O2 丙:Ag2O、NO2、N2
(1)实验前,小组成员经讨论认定猜想丙不成立,理由是不符合氧化还原反应原理.
查阅资料得知:
2NO2+2NaOH═NaNO3+NaNO2+H2O;Ag2O与粉末态的Ag均为黑色;Ag2O可溶于氨水.针对甲、乙猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,首先进行的操作是检验装置的气密性.
②将AgNO3固体置于A中,加热前通入N2以驱尽装置内的空气,其目的是避免对产物O2检验产生干扰;关闭K,用酒精灯加热时,正确操作是先移动酒精灯预热硬质玻璃管,然后固定在管中固体部位下加热.
③观察到A 中有红棕色气体出现,C、D 中有气泡.
④待样品完全分解,A 装置冷却至室温.
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论
①证明一定有O2生成的依据是C中的溶液不褪色,且D中的溶液褪色,与此相关的化学原理为Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4(用化学方程式表示).
②针对试管中残留黑色固体的成分,该学习小组进行了如下探究:
【提出假设】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?有,应在AB装置间增加防倒吸的装置.
2.下列离子方程式正确的是( )
| A. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O | |
| B. | Na2O2与H2O反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
19.苯甲酸粗品中含有泥沙和杂质 A(随温度变化 A 的溶解度变化很小),可通过系列操 作完成苯甲酸的提纯.则下列叙述正确的是( )
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
6.下列叙述正确的是( )
| A. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
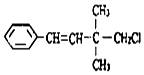
| B. |  和 和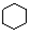 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香族化合物 既是芳香烃又是芳香族化合物 | |
| C. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| D. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有5种 |
16.除去下列括号内杂质的试剂或方法错误的是( )
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
3.某有机物的结构简式如图,关于该有机物的下列叙述中不正确的是( )

| A. | 一定条件下,能发生加聚反应 | |
| B. | 该有机物苯环上的一溴代物有3种 | |
| C. | 能使酸性KMnO4溶液、溴水褪色,且原理相同 | |
| D. | 1mol该有机物在一定条件下最多能与4molH2发生反应 |
20. 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4的沸点比P4(白磷)的高 | |
| C. | 理论上可以将N4转化为N2的反应设计成原电池 | |
| D. | 1mol N4所含有的能量比2mol N2所含有的能量高 |
1. 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )
 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )| 选项 | I中试剂 | Ⅱ中试剂及现象 | 推断 |
| A | 氯化铵 | 酚酞溶液变红 | 氯化铵容易分解 |
| B | 亚硫酸氢钠 | 溴水褪色 | SO2气体具有漂白性 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾褪色 | 石蜡油发生了化学变化 |
| D | 高锰酸钾 | 肥皂水冒泡 | 反应生成了氧气 |
| A. | A | B. | B | C. | C | D. | D |