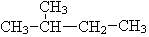题目内容
15.下列各组物质中所含化学键类型完全相同的是( )| A. | NaF、NH4Cl | B. | NaOH、NaClO | C. | CaO、Na2O2 | D. | MgCl2、Mg(OH)2 |
分析 选项中物质含有的化学键分为离子键和共价键,离子键为活泼金属与活泼非金属之间形成的化学键,共价键为非金属性较强的原子之间形成的化学键,共价键分为极性共价键和非极性共价键,以此解答该题.
解答 解:A.NaF只含有离子键,NH4Cl含有离子键和共价键,故A错误;
B.NaOH、NaClO都含有离子键和共价键,故B正确;
C.CaO含有离子键,Na2O2含有离子键和共价键,故C错误;
D.MgCl2含有离子键,Mg(OH)2含有离子键和共价键,故D错误.
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列反应中,不属于取代反应的是( )
| A. | 乙烯与氯化氢反应生成氯乙烷 | B. | 乙醇与乙酸反应生成乙酸乙酯 | ||
| C. | 苯与硝酸反应生成硝基苯 | D. | 乙烷和氯气光照下反应 |
4.下列事实不能用平衡移动原理解释的是( )
| A. | 由H2、I2(g)、HI组成的平衡体系,缩小体积后颜色加深 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 | |
| D. | 加压有利于N2和H2在一定的条件下转化为NH3 |
10.下列化学反应的离子方程式正确的是( )
| A. | 将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | 向稀氨水中通入少量CO2:2NH3•H2O+CO2═2NH4++CO32-+H2O | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 将醋酸滴入硅酸钠溶液中:SiO32-+2H+═H2SiO3↓ |
20.下列含有共价键的离子化合物是( )
| A. | CO2 | B. | NaOH | C. | CaF2 | D. | 金刚石 |
7.氯化钠是日常生活中常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 熔融状态能导电 | D. | 具有较高的熔点 |
9.如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入0.23gNa、0.62gNa2O、0.78gNa2O2、0.4gNaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )

| A. | 甲<乙<丙<丁 | B. | 丁<甲<乙=丙 | C. | 甲=丁<乙=丙 | D. | 丁<甲<乙<丙 |
 和
和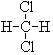 ; ⑦CH3 (CH2) 3CH3和
; ⑦CH3 (CH2) 3CH3和